Тромбоциты (кровяные пластинки) — очень маленькие (диаметром (3)–(4) мкм), безъядерные (у человека) плоские клетки неправильной формы. Они постоянно образуются в красном костном мозге и живут всего несколько суток. Число их в крови человека колеблется от (200) до (400) тыс. в (1) мм³.
Основная функция тромбоцитов — способствовать остановке кровотечения. Они обладают свойством изменять свою форму (распластываться, сжиматься и т. п.), обеспечивая образование кровяного сгустка (тромба).
- Свёртывание крови — важнейшая защитная реакция, предохраняющая организм от кровопотери при разрушении сосудов.
- Для взрослого мужчины условно смертельно опасной является потеря (1,5)–(2,0) л крови, а вот женщина может перенести потерю даже (2,5) л, хотя это, конечно, приводит к отрицательным последствиям.
- Свёртывание крови — сложный процесс, в ходе которого из разрушенных тромбоцитов, повреждённых тканей мышц и сосудов выделяются особые биологически активные вещества — факторы свёртывания крови (их насчитывают более (10)).
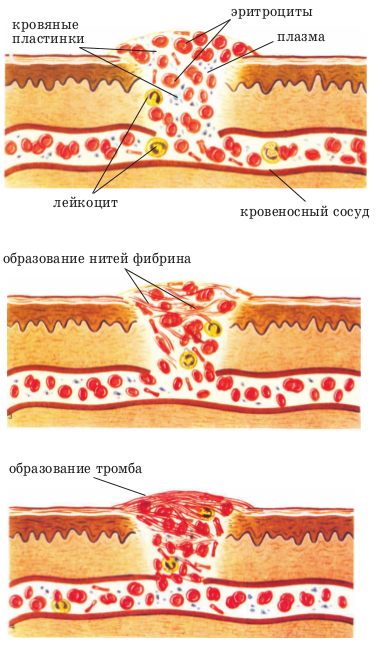
При повреждении сосуда (например, при порезе) тромбоциты, находящиеся в этом месте, разрушаются и выделяют протромбин, который переводит растворимый белок плазмы крови фибриноген в нерастворимый белок фибрин.
Длинные нити фибрина переплетаются между собой в сеть, где задерживаются форменные элементы крови, и образуется тромб, перекрывающий рану и прекращающий кровотечение. Образование тромба происходит в течение (3)–(8) мин.
Со временем стенка сосуда восстанавливается, а тромб рассасывается.
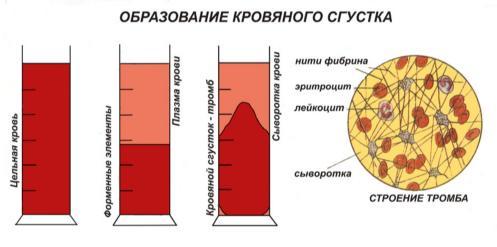
При свёртывании крови вне организма, после отделения от неё кровяного сгустка, образуется сыворотка крови. Сыворотка почти соответствует плазме по составу крови, но в ней отсутствует фибриноген.
Нарушения свёртываемости крови
Отсутствие в крови факторов её свертывания или же нарушение их образования в организме приводит к тяжёлым заболеваниям. Одно из них — гемофилия.
У больного гемофилией кровь не свёртывается, и человек может погибнуть от кровотечения при самых незначительных повреждениях сосудов. Гемофилией страдают исключительно мужчины (т. к.
в организме человека за её развитие отвечает ген, находящийся в мужской половой хромосоме). Но подверженность этой болезни в роду передаётся по женской линии.

Пример:
сын последнего Российского императора Николая (II) — цесаревич Алексей — страдал гемофилией, которую он унаследовал от матери — императрицы Александры Фёдоровны (внучатой племянницы английской королевы Виктории, которая была носителем гена гемофилии).

Важную роль в процессе свёртывания крови играют и соли кальция. Если их удалить, то кровь утрачивает способность свёртываться.
Источники:
Любимова З. В., Маринова К. В. Биология. Человек и его здоровье. 8 класс. — М.: Владос.
Иллюстрации:
https://www.bbc.com/russian/science/2009/10/091008_royal_blood.shtml
https://ebiology.ru/sostav-i-funkcii-krovi-immunitet/
Занятие 20. Взятие крови у животных. Получение плазмы, сыворотки, фибрина и дефибринированной крови. Определение скорости свертывания крови при различных температурных условиях
Раздел ФИЗИОЛОГИЯ КРОВИ.
ЦЕЛЬ
ЗАНЯТИЯ: Ознакомиться
с методами взятия крови у сельскохозяйственных
животных, изучить соотношение и
взаимосвязь составных частей крови,
получить плазму, сыворотку, дефибринированную
кровь и фибрин, определить время
свертывания крови при различных
температурных условиях.
Работа
1.
Получение крови у животных.
Для
взятия крови у животных производят
обработку операционного поля (выстригание
и выбривание волосяного покрова,
протирание кожи спиртом и эфиром), а
затем надрезают (прокалывают) кровеносный
сосуд или вводят в него иглу определенной
формы и диаметра, предварительно
подвергнутые стерилизации. Принудительной
фиксация животных при взятии крови
следует избегать. Для получения крови
у мелких животных и птиц иногда прибегают
к пункции желудочка сердца.
Лошади
крупный и мелкий рогатый скот.
Небольшие
количества крови для морфологического
анализа у лошадей и крупного рогатого
скота получают из ушной вены путем её
надреза или прокола инъекционной иглой.
Для получения большого количества
крови, а также для внутренних вливаний
производят пункцию яремной вены на
границе верхней и средней трети шеи
(рис. 48).
После
фиксации животного большим пальцем
левой руки сдавливают вену ниже места
пункции (у крупного и мелкого рогатого
скота накладывают резиновый жгут), затем
прокалывают кровопускательной иглой
кожу и стенку ванн. Иглу вводят против
тока крови под углом 45°. Кровь собирают
в стерильный сосуд.
Свиньи.
У
свиней малые количества крови получают
путем надреза скальпелем большой ушной
вены. Центральный, конец сосуда у корня
уха зажимают при этом пальцами. Для
получения большого количества крови
отсекают ножницами или скальпелем
отрезок хвоста длиной 1…1.5 см.
А — с левой стороны,
Б — с правой стороны.
Рис.
48. Взятие крови у лошади из яремной
вены.
По
окончании кровопускания рану дезинфицируют,
а кончик хвоста сдавливают резиновым
кольцом или перетягивают бинтом на
1…2 суток.
Собаки.
Небольшие
количества крови у собак (кошек) получают
путем надреза уха или прокола мягкой
части ступни.
Для получения больших
порций крови производят пункцию
переднепружной плюсневой вены,
расположенной на наружной поверхности
голени (рис. 49).
Животное кладут на бок
или фиксируют в станке, конечности
сдавливают руками или жгутом ниже
коленного сустава. Иглой прокалывают
сначала кожу, а затем — стенку вены,
насасывают кровь в шприц.
Кролики.
Малое
количество крови у кроликов получают
путем надреза или прокола вены,
расположенной снаружи по тонкому краю
уха. Местом кровопускания может служить
и грудная вена, расположенная на грудной
клетке сбоку. В некоторых случаях
прибегают к пункции сердца.
Рис. 49. Пункция
переднепружной плюсневой вены у собак.
Птицы.
Небольшие
порции крови у кур и индеек получают
путем надреза или скарификации гребня
(сережек). У гусей и уток делают прокол
мякоти ступни. В большом количестве
кровь у птиц получают из подкожной
под-крыльцевой вены, расположенной на
внутренней поверхности крыла. Перья
выщипывают, вену сдавливают пальцем в
области локтевого сустава, прокол
делают под углом на уровне локтевого
сгиба.
Заполнить
таблицу 14 получения большого и малого
количества крови у разных видов животных.
Таблица
14
| Вид животных | Места взятия крови у животных |
| большое количество крови | малое количество крови |
| Лошадь, крупный и мелкий рогатый скот | |
| Свиньи | |
| Собаки | |
| Кролики | |
| Птицы |
Получение дефибринированной крови. Кровь животного сливают в стерильную колбу со стеклянными бусами и непрерывно в течение 10–15 мин встряхивают. В результате встряхивания находящийся в крови фибрин выпадает в осадок, обволакивая бусы, а дефибринированная кровь, слитая в другую колбу или пробирку, утрачивает способность свертываться.
Приготовление взвеси эритроцитов. Для освобождения от пленок фибрина дефибринированную кровь фильтруют через трехслойный марлевый фильтр. Фильтрат наливают в центрифужные пробирки и центрифугируют при 2000–3000 об./мин в течение 10–15 мин. Эритроциты оседают на дно пробирки, а прозрачная, слегка желтоватого цвета плазма образует над-осадочный слой.
После центрифугирования уровень жидкости в пробирке отмечают карандашом, отделяют плазму пастеровской пипеткой, эритроциты промывают, доливая до метки стерильный изотонический раствор хлорида натрия, и вновь центрифугируют. Промывание эритроцитов с добавлением свежего раствора производят 2–3 раза, чтобы последняя порция промывной жидкости была бесцветна.
Из промытых эритроцитов готовят 3 или 5 % взвесь, прибавляя к 3–5 мл эритроцитов соответственно 97–95 мл изотонического раствора хлорида натрия (для получения меньших количеств взвеси объемы обоих ингредиентов уменьшают в одинаковое число раз).
Взвесь эритроцитов можно хранить в холодильнике при температуре 3–4 °С в течение 5–6 дней.
Приготовление сыворотки крови. Кровь, собранную в стерильную пробирку, закрывают ватно-марлевой пробкой, ставят на 20–30 мин в термостат или водяную баню, отрегулированную на 37 °С, так как в тепле кровь свертывается быстрее и лучше.
При свертывании сгусток крови обычно прилипает к стенкам пробирки. Поэтому после выдерживания в термостате сгусток отделяют от стенок пробирки круговым движением капилляра стерильной пастеровской пипетки или стеклянной стерильной палочкой.
После отделения сгустка сыворотку ставят в холодильник при температуре 3–4 °С. В течение 3–4 ч сыворотка обычно отделяется полностью, и ее можно собрать стерильной пастеровской пипеткой.
Чтобы содержимое пробирки было хорошо видно, пастеровскую пипетку соединяют со стеклянной трубкой – «мундштуком» (резиновая трубка длиной 20–25 см).
Это позволяет избежать соприкосновения кончика пипетки со сгустком крови и попадания в сыворотку эритроцитов.
Окрашенную в розовый цвет сыворотку центрифугируют при 2000–3000 об./мин в течение 10–15 мин для осаждения форменных элементов крови.
При взятии крови вскоре после кормления животных, а также при повторных кровопусканиях с короткими интервалами иногда возникает липемия, т.е. появление избытка жировых веществ в крови. Сыворотки, получаемые во время липемии, бывают мутные (хилезные), иногда опалесцирующие, и это очень затрудняет чтение диагностических реакций, особенно реакции преципитации.
Во избежание получения мутных сывороток кровь у животных берут натощак. Просветление липе-мической плазмы наступает также при введении в кровеносное русло животного гепарина, способствующего повышению концентрации в крови фермента, называемого фактором просветления.
С этой целью кроликам весом 2–2,5 кг в краевую вену уха вводят за 1–1,5 ч до обескровливания 60 мг гепарина.
Сыворотку крови можно получить методом центрифугирования. В слитой с осадка сыворотке через короткое время после центрифугирования образуется сгусток фибрина, который уплотняется при перемешивании крови стеклянной палочкой. Затем этот сгусток удаляют.
В некоторых случаях фибрин из сыворотки выпадает не полностью. Для удаления остатков фибрина и выявления полноты его удаления к сыворотке прибавляют несколько капель тромбина. Освобожденную от фибрина сыворотку фильтруют через асбестовые фильтры.
Полученная таким способом сыворотка совершенно прозрачна и не имеет признаков опалесценции.
Приготовление цитратной крови. Полученную из сердца или вены кровь сливают в пробирку с 5 % раствором цитрата натрия (10 мл крови, 1 мл цитрата натрия). Цитратная кровь не свертывается.
Приготовление плазмы крови. Цитратную кровь ставят на 18–20 ч в холодильник или центрифугируют. В результате над осадком эритроцитов образуется прозрачный слой жидкости желтоватого цвета – плазмы.
Свертывание крови, ее дефибринизация и стабилизация
Выпущенная из тела животного кровь обладает способностью быстро свертываться и образовывать желеобразный сгусток, закупоривающий раневое отверстие и останавливающий кровотечение.
Сущность процесса свертывания крови заключается в выпадении, под влиянием особых ферментов, из коллоидного раствора белка плазмы фибриногена, образующего при этом волокнообразную массу тончайших нитей фибрина. Эти нити захватывают в свои петли форменные тела крови, что и приводит к образованию кровяного сгустка (рис.).
Рис. Свертывание плазмы крови (видно выпадение нитей фибрина)
Процесс свертывания крови протекает несколькими этапами. При выходе крови начинают распадаться тромбоциты, освобождая фермент тромбокиназу.
Тромбокиназа активирует постоянно растворенный в крови, но находящийся в неактивной форме фермент тромбоген, превращая его в тромбин.
Последний при содействии солей кальция крови расщепляет фибриноген плазмы на выпадающий из раствора волокнистый фибрин и остающееся растворенным в плазме фибринопластическое вещество.
Быстрота свертывания крови разных видов животных различна. Так, кровь крупного рогатого скота при комнатной температуре свертывается через 6,5 минуты, овцы через 2,5 минуты, свиньи через 3,5 минуты и лошади через 11,5 минуты. Повышение температуры среды ускоряет процесс свертывания.
Сгусток крови, образующийся при ее свертывании, постепенно сжимается, выделяя прозрачную светложелтую сыворотку крови, которая отличается от плазмы живой крови тем, что в ней нет фибриногена.
Промывая сгусток крови водой, можно удалить форменные элементы крови и растворимые части плазмы и получить чистый фибрин, имеющий вид белой или желтоватой волокнистой массы.
Свежую кровь сбиванием или перемешиванием можно дефибринировать, так как волокна осаждающегося фибрина будут оседать на мешалке, следовательно, легко могут быть отделены от общей массы крови.
Дефибринированная кровь уже не способна свертываться и образовывать сгустки. Свертывание крови можно предупредить также ее стабилизацией путем добавления поваренной соли.
Стабилизация крови поваренной солью вызывает ее гемолиз (растворение гемоглобина в плазме крови), почему при сепарировании такой крови получается не желтый, а алый серум.
Стабилизацию крови обычно производят так. В сосуд, куда предполагается собрать кровь, предварительно наливают крепкий раствор соли (320 куб. см соли на 1 л воды) из расчета 100-120 куб. см раствора на 1 л крови. После этого в сосуд пускают кровь и перемешивают ее с рассолом в течение 30-40 секунд. Стабилизация крови может быть достигнута также примесью раствора лимоннокислого натрия.
Свертывание крови
Выпущенная из кровеносного сосуда кровь вначале быстро вытекает, но спустя короткий промежуток времени теряет свойства жидкости и свертывается, образуя сгусток.
Свертывание крови разных животных происходит с различной скоростью. Так, кровь крупного рогатого скота свертывается через 6,5 мин, мелкого рогатого скота 2,5, свиней 3,5, лошадей 11,5 мин.
Свертывание крови является сложным ферментативным процессом, состоящим из цепи взаимосвязанных реакций. В данном процессе участвует 13 факторов. В результате протекания процесса свертывания крови содержащийся в плазме крови растворимый белок (фибриноген) превращается в нерастворимый белок (фибрин).
Если свежевыпущенная кровь находится в спокойном состоянии, нити фибрина образуют сетку, в которой заключены все составные части Крови. Если же свежевыпущенную кровь сразу начать перемешивать, то образующиеся нити фибрина наматываются на мешалку и кровь остается жидкой.
Такая кровь, лишенная фибрина, называется дефибринированной.
При понижении температуры свертывание крови замедляется. Так, кровь крупного рогатого скота при температуре 10 °С свертывается только через 20 мин.
Процесс свертывания крови протекает в три фазы. На первой фазе происходит образование активного тромбопЛастина. Вторая фаза характеризуется превращением протромбина в тромбин. Третья фаза заключается в образовании фибрина из фибриногена под влиянием тромбина.
При повреждении кровеносных сосудов, ранениях, травмах из поврежденных клеток высвобождается тканевый тромбопластин, который активируется проконвертином (фактор VII). Плазменный тромбопластин также участвует в свертывании крови. Тромбопластин, содержащийся в тромбоцитах, под действием ряда факторов в присутствии ионов кальция превращается в активную тромбокиназу.
Последняя действует на содержащийся в плазме крови протромбин в присутствии ионов кальция и приводит к образованию тромбина. Под действием тромбина фибриноген переходит в неустойчивый растворимый мономер фибрина. Последний под влиянием фибринстабилизирующего фактора XIII переходит в фибринполимер, который поддерживается в нерастворимом состоянии.
Процесс под влиянием ионов кальция заканчивается образованием сгустка фибрина.
Процесс свертывания крови можно ускорить различными факторами. К их числу относится применение витамина К, способствующего образованию белка протромбина в печени, а также регулирование температуры.
Так, скорость свертывания крови при температуре 13,7 °С равна 18,5 мин, а при температуре 39,9 °С — 2,75 мин. Характер поверхности, с которой соприкасается кровь, также имеет важное значение.
Шероховатая поверхность ускоряет свертывание, а гладкая — задерживает.
Основными причинами, замедляющими свертывание крови, являются недостаток одного или нескольких факторов свертывания крови, избыток антикоагулянтов.
Кроме того, замедлению свертывания крови способствует недостаточное количество тромбоцитов (болезнь Верльгофа, гепатиты, отравление фосфором и др.
), авитаминоз и гиповитаминоз витамина К, а также причины, нарушающие синтез тромбина, проконвертина и фибриногена, избыточное образование гепарина, инактивация протромбина, тромбина, большое поступление в кровь тканевой фибринокиназы.
В организме процесс свертывания крови находится под контролем гормонов коры надпочечников. При этом одни из них (глюкокортикоиды) ускоряют процесс свертывания, а другие (минерало — кортикоиды) — замедляют. Так, адренокоргакотропный гормон ускоряет процесс свертывания, препятствуя в проявлении действия естественного антикоагулянта — гепарина, задерживая его поступление из печени в кровь.
В практике важное значение имеет предотвращение свертывания крови. Процесс предотвращения свертывания крови введением в кровь определенных веществ называется стабилизацией. Стабилизация крови обусловлена исключением одного из компонентов, входящих в систему свертывания крови.
Из наиболее распространенных методов стабилизации следует назвать те, которые основываются на исключении ионов кальция из системы свертывания крови. В качестве стабилизаторов такого типа следует назвать соли щавелевой, фосфорной, фтористоводородной, лимонной и триоксиглутаровой кислот.
Для лечебных целей кровь стабилизируют лимоннокислым натрием, а для пищевых целей — солями пирофосфорной кислоты.
Нейтральные соли образуют стойкие комплексы с фибриногеном, что способствует задержке свертывания крови. На этом основано применение поваренной соли для предупреждения свертывания крови, направляемой в колбасное производство.
Гепарин, содержащийся в печени, легких и мышцах, гирудин, образующийся в ротовой полости пиявок, — являются естественными стабилизаторами крови.
Гепарин задерживает свертывание крови в сосудах, которое может наступать в результате разрушения тромбоцитов и активации тромбокиназы.
Активность гепарина крупного рогатого скота вдвое больше, чем гепарина свиней, поэтому свиная кровь свертывается быстрее.
Решу егэ
Задание 14 № 22269
Установите правильную последовательность процессов, происходящих при свёртывании крови у человека. Запишите в таблицу соответствующую последовательность цифр.
- 1) образование тромба
- 2) взаимодействие тромбина с фибриногеном
- 3) разрушение тромбоцитов
- 4) повреждение стенки сосуда
- 5) образование фибрина
- 6) образование протромбина
Пояснение.
- Последовательность процессов, происходящих при свёртывании крови у человека: повреждение стенки сосуда → разрушение тромбоцитов → образование протромбина → взаимодействие тромбина с фибриногеном → образование фибрина → образование тромба.
- Ответ: 436251.
- Примечание.
Свертывание крови – это защитный механизм, предотвращающий потерю крови при ранениях кровеносных сосудов. Процесс свертывания заключается в последовательной цепи биохимических превращений белков плазмы. По современным представлениям существует не менее 12 веществ-факторов свертывания.
- Основная последовательность процессов свертывания следующая:
- тромбоциты разрушаются при контакте с неровными краями раны сосуда, и при этом из разрушившихся клеток выделяется активный фермент тромбопластин
- тромбопластин взаимодействует с неактивным белком плазмы протромбином, и последний переходит в активное состояние — фермент тромбин
- тромбин действует на растворимый белок плазмы фибриноген и переводит его в нерастворимый белок фибрин
- фибрин выпадает в виде белых тонких нитей, которые натягиваются в области раны в виде сеточки
- в нитях фибрина оседают эритроциты, лейкоциты, формируется полужидкий кровяной сгусток
- нити фибрина сокращаются, отжимают жидкую часть из сгустка, и формируется тромб.
На всех этапах свертывания крови обязательно должны присутствовать ионы кальция и витамин К. Время свертывания крови у человека составляет 5—12 минут. Недостаток какого-либо фактора свертывания приводит к снижению свертывания.
- ———-
- Дублирует задание 19091
- ———-
Формулировка вопроса некорректна. Протромбин (профермент, неактивная форма тромбина) постоянно синтезируется в печени и постоянно присутствует в плазме, а НЕ образуется при свертывании крови.
В задании целесообразно заменить «6) образование протромбина» на «6) активация протромбина» или на «6) образование тромбина», поскольку при повреждении кровеносных сосудов запускаются процессы, приводящие к превращению постоянно присутствующего в крови протромбина в активную форму — тромбин (фермент), который превращает растворимый фибриноген в нерастворимый фибрин.
Ответ: 436251
Раздел кодификатора ФИПИ: 5.3 Внутренняя среда организма человека. Группы крови. Переливание крови. Иммунитет
06. Как получит сыворотку и плазму крови
Оборудование
- Центрифужные стеклянные пробирки общим объемом 10-12 мл.
- Стеклянные палочки или Пастеровские пипетки с запаянными на конце капиллярами (для отделения сгустка).
- Центрифуга лабораторная (до 3000 об/мин).
Приготовление сыворотки
Венозная кровь, полученная без антикоагулянтов в центрифужную стеклянную пробирку, отстаивается в ней при комнатной температуре (15-200С) в течение 30 минут до полного образования сгустка.
По окончании образования сгустка пробирки открывают и осторожно проводят тонкой стеклянной палочкой или запаянным капилляром Пастеровской пипетки по внутренним стенкам пробирки по окружности в верхнем слое крови для отделения столбика сгустка от стенок пробирки.
Сыворотку сливают в другую центрифужную пробирку, придерживая сгусток стеклянной палочкой, и центрифугируют, либо центрифугируют в тех же, первичных, пробирках.
Центрифугирование
После ретракции сгустка пробы центрифугируют при относительной центробежной силе RCF от 1000 до 1200 xg (максимально до 1500 xg) в течение 10 минут.
В случае использования микропробирок и центрифуги для них центрифугирование проводят при 6000-15000 xg в течение 1,5 минут. После центрифугирования сыворотку сливают во вторичные (транспортные) пробирки. Сыворотка не должна быть гемолизированной.
Плазма получается из крови путем отделения клеток крови. Она представляет собой бесклеточную надосадочную жидкость, которая получается при центрифугировании крови, свертываемость которой ингибирована добавлением антикоагулянтов тотчас после взятия. В плазме содержатся факторы свертывания крови.
В связи с тем, что плазма и сыворотка содержат около 93% воды, в отличие от цельной крови, которая содержит около 81% воды, концентрация компонентов в плазме на 12% выше, чем в цельной крови.
Это может иметь принципиальное диагностическое значение при исследовании активности, например, ЛДГ у которого наиболее высокая концентрация наблюдается в сыворотке крови, чем в плазме.
Широко применяются коммерческие системы для получения плазмы. Они представляют собой пробирки или устройства типа шприцев (“вакутейнер”) с вакуумом внутри, содержащие различные антикоагулянты и/или ингибиторы гликолиза.
Как и в случае устройств для сыворотки, эти пробирки для плазмы имеют разные варианты, содержащие разделительные гели и гранулят из полистирола, ускоряющие получение плазмы, облегчающие транспортировку и хранение.
В них уже имеются антикоагулянты и метки до которых следует набирать кровь.
Методика получения плазмы
Приготовление плазмы
Венозную кровь, полученную с антикоагулянтом немедленно после взятия перемешивают переворачиванием пробирок с кровью, закрытых крышками, не менее 5 раз. Перемешивание должно осуществляться без встряхивания и пенообразования. Время между началом наложения жгута и смешиванием крови с антикоагулянтом не должно превышать 2 минут.
После уравновешивания пробирок с кровью, их центрифугируют при RCF 1000-1200 xg, но не более 1500 xg, в течение 10-15 минут. Плазму немедленно сливают в транспортную центрифужную или химическую пробирку. Пробирку закрывают крышкой.
Условия транспортировки плазмы крови
Правильно полученная и собранная плазма крови должна быть своевременно доставлена в лабораторию. При комнатной температуре время доставки не должно превышать 24 часа.
Если доставка плазмы в лабораторию осуществляется в течение дня, то она хранится при температуре +4…+80С (в холодильнике) и далее в специальных транспортных контейнерах в ледяной бане доставляется в лабораторию.
Для более длительного хранения плазма может быть заморожена при температуре –200 С
Взятие, условия хранения и доставки венозной крови для проведения ИФА и ПЦР
Подготовка обследуемых
Взятие венозной крови производится натощак, в утренние часы. При взятии венозной крови необходимо учитывать ряд факторов которые могут повлиять на результат гематологических исследований: физическое перенапряжение (бег, быстрая ходьба, подъем по лестнице), эмоциональное возбуждение, прием пищи накануне исследования, купение, прием алкоголя и т.д.
Для исключения этих факторов, следует соблюдать следующие условия подготовки пациентов: • взятие венозной крови осуществляется после 15-минутного отдыха обследуемого; • пациент во время взятия сидит, у тяжелых больных взятие крови может осуществляться лежа.
• курение, прием алкоголя и пищи непосредственно перед исследованием исключаются; Основной способ взятия венозной крови для лабораторного исследования – пунктирование вены. Венозную кровь, как правило, забирают из локтевой вены. В случае необходимости ее можно получить из любой вены (запястья, тыла ладони, над большим пальцем и т.д.).
У новорожденных и грудных детей кровь обычно берется из лобной, височной или яремной вены.
- При взятии крови из вены необходимо избегать: мест шрамов, гематом; вен, используемых для переливания растворов; ножных вен (у больных диабетом, при нарушениях периферического кровотока, ангиопатиях).
- Оборудование
- Для венепункции можно использовать три варианта пункционных систем: • одноразовые пластиковые системы (вакутейнеры), состоящие из контейнера с навинчивающейся на него одноразовой иглой и пробирки с плотно прилегающей пробкой и вакуумом внутри; • одноразовые шприцы с подходящим диаметром иглы; • иглы с внутренним диаметром 0,55-0,65 мм.
- Условия транспортировки венозной крови
Правильно собранная венозная кровь должна быть своевременно доставлена в лабораторию. При комнатной температуре время доставки не должно превышать 60 мин после взятия крови.
Если доставка крови в лабораторию осуществляется в течении дня, то она хранится при температуре +40С-+60С (в холодильнике) и далее в специальных транспортных контейнерах в ледяной бане доставляется в лабораторию.
Во время транспортировки пробирки и контейнеры с кровью должны быть соответствующим образом защищены от вредного воздействия окружающей среды и погодных условий. При транспортировке венозной крови должны строго соблюдаться правила техники безопасности, асептики и антисептики.
Пробирки должны быть промаркированы, упакованы и плотно закрыты. Упаковка должна быть удобной для транспортировки. Сроки хранения зависят от исследуемого показателя, температуры хранения и антикоагулянта, с помощью которого осуществляется взятие крови.
Методика получения сыворотки крови (без использования разделительных или вспомогательных средств для центрифугирования)
Оборудование 1. Центрифужные стеклянные пробирки общим объемом 10-12 мл. 2. Стеклянные палочки или Пастеровские пипетки с запаянными на конце капиллярами (для отделения сгустка). 3. Центрифуга лабораторная (до 3000 об/мин).
Приготовление сыворотки
Венозная кровь, полученная без антикоагулянтов в центрифужную стеклянную пробирку, отстаивается в ней при комнатной температуре (15-200С) в течение 30 минут до полного образования сгустка.
По окончании образования сгустка пробирки открывают и осторожно проводят тонкой стеклянной палочкой или запаянным капилляром Пастеровской пипетки по внутренним стенкам пробирки по окружности в верхнем слое крови для отделения столбика сгустка от стенок пробирки.
Сыворотку сливают в другую центрифужную пробирку, придерживая сгусток стеклянной палочкой, и центрифугируют, либо центрифугируют в тех же, первичных, пробирках.
Центрифугирование
После ретракции сгустка пробы центрифугируют при относительной центробежной силе RCF от 1000 до 1200 xg (максимально до 1500 xg) в течение 10 минут. В случае использования микропробирок и центрифуги для них центрифугирование проводят при 6000-15000 xg в течение 1,5 минут. После центрифугирования сыворотку сливают во вторичные (транспортные) пробирки.
Сыворотка не должна быть гемолизированной. Плазма получается из крови путем отделения клеток крови. Она представляет собой бесклеточную надосадочную жидкость, которая получается при центрифугировании крови, свертываемость которой ингибирована добавлением антикоагулянтов тотчас после взятия. В плазме содержатся факторы свертывания крови.
В связи с тем, что плазма и сыворотка содержат около 93% воды, в отличие от цельной крови, которая содержит около 81% воды, концентрация компонентов в плазме на 12% выше, чем в цельной крови.
Это может иметь принципиальное диагностическое значение при исследовании активности, например ЛДГ у которого наиболее высокая концентрация наблюдается в сыворотке крови, чем в плазме.
Широко применяются коммерческие системы для получения плазмы. Они представляют собой пробирки или устройства типа шприцев (“вакутейнер”) с вакуумом внутри, содержащие различные антикоагулянты и/или ингибиторы гликолиза.
Как и в случае устройств для сыворотки, эти пробирки для плазмы имеют разные варианты, содержащие разделительные гели и гранулят из полистирола, ускоряющие получение плазмы, облегчающие транспортировку и хранение.
В них уже имеются антикоагулянты и метки до которых следует набирать кровь.
- Методика получения плазмы
- Приготовление плазмы
Венозную кровь, полученную с антикоагулянтом немедленно после взятия перемешивают переворачиванием пробирок с кровью, закрытых крышками, не менее 5 раз. Перемешивание должно осуществляться без встряхивания и пенообразования. Время между началом наложения жгута и смешиванием крови с антикоагулянтом не должно превышать 2 минут.
После уравновешивания пробирок с кровью, их центрифугируют при RCF 1000-1200 xg, но не более 1500 xg, в течение 10-15 минут. Плазму немедленно сливают в транспортную центрифужную или химическую пробирку. Пробирку закрывают крышкой.
Условия транспортировки плазмы крови Правильно полученная и собранная плазма крови должна быть своевременно доставлена в лабораторию. При комнатной температуре время доставки не должно превышать 24 часа. Если доставка плазмы в лабораторию осуществляется в течение дня, то она хранится при температуре +4…
+80С (в холодильнике) и далее в специальных транспортных контейнерах в ледяной бане доставляется в лабораторию. Для более длительного хранения плазма может быть заморожена при температуре –200С.
Правила транспортировки плазмы такие же как и венозной крови.
Наполнители для вакуумных пробирок: какие бывают и как работают — Проба
Сыворотка крови – жидкая часть крови лишенная форменных элементов и некоторых белков (фибрин и др.) в отличие от плазмы, в которой сохраняются все элементы жидкой части крови кроме форменных элементов.
Получение сыворотки крови является результатом двухступенчатого биохимического процесса: свертывания (коагуляции) крови и ретракции (уплотнения) сгустка.
Для запуска коагуляционного каскада необходимо наличие внешнего активатора, каковым может служить диоксид кремния, поэтому процесс свертывания крови быстрее происходит в стеклянных пробирках, так как кремния диоксид является базовым материалом стекла или в пластиковых пробирках с активатором свертывания. Активатор свертывания (clot activator) выполнен в виде напыления на внутренней стенке пробирки.
После образования сгустка начинается этап его уплотнения и выделения сыворотки. На практике ретракция сгустка ускоряется центрифугированием пробирок с кровью.
Для получения максимально чистой сыворотки рекомендуется соблюдение трёх условий:
- После забора крови в пробирку в соответствии с инструкцией необходимо осторожно однократно перевернуть пробирку для более полного контакта крови с активатором свертывания;
- Дождаться завершения процесса свертывания крови в течение 20-30 минут при комнатной температуре и вертикальном положении пробирки;
- Центрифугировать пробирку со свернувшейся кровью не менее 10 минут с ускорением 1500 G (примерно 3000 об/мин) для максимального выдавливания сыворотки из сгустка. При необходимости допускается центрифугирование с ускорением 4000G c крышечкой и до 12000G без крышечки.
После центрифугирования и полной ретракции сгустка сыворотка располагается над сгустком, но в контакте с ним. Сохраняется опасность загрязнения сыворотки составляющими сгустка при неосторожном обращении с пробиркой (встряхивание, опрокидывание и пр.).
Для лучшего очищения сыворотки и более полного разграничения сыворотки и сгустка применяются специальные пробирки, содержащие биологически инертный олефиновый гель.
Последний представляет собой тиксотропный кополимер, который тяжелее сыворотки, но легче кровяного сгустка, поэтому после центрифугирования гель в виде тонкой полоски занимает промежуточное положение и служит разделительным барьером. Стабильность такого барьера гарантирована в течение 5-7 дней при хранении пробирки с кровью при комнатной температуре.
Оптимальные сроки сохранности образца крови в данных пробирках составляет при комнатной температуре 6 часов, при хранении в холодильнике (+4ºС) – 24 часа. Повторное центрифугирование пробирок, особенно с гелем, не допускается.
Полученная сыворотка крови применяется для очень широкого спектра лабораторных биохимических, ИФА и иммунологических исследований:
- белковый состав,
- ферменты,
- гормоны,
- онкомаркеры,
- ВИЧ-инфицирование, гепатиты и пр.
Антикоагулянты для получения цельной крови или плазмы
Не все анализы в клинике делаются из сыворотки крови. Для многих видов исследований необходима цельная кровь, содержащая форменные элементы, или плазма, освобожденная от клеток крови центрифугированием.
Для получения несвернувшейся крови разработаны пробирки с определенными добавками — антикоагулянтами. На практике используют два вида антикоагулянтов:
- Ингибиторы (вещества, вызывающие торможение) тромбина. Тромбин играет ключевую роль в коагуляционном каскаде. Он принимает участие в формировании факторов свертывания крови и способствует трансформации фибриногена в фибрин. Добавление биохимических ингибиторов тромбина эффективно активирует антикоагуляционные свойства крови.
- Связывание (удаление) ионов Ca2+. При прочих равных условиях свертывание крови происходит при активном участии ионов Ca2+. Удаление их является эффективным механизмом сохранения крови в жидком состоянии.
Гепарин
Гепарин — кислый мукополисахарид с молекулярной массой 4 000–40 000 – является натуральным антикоагулянтом, присутствующем в любом здоровом организме. Гепарин активирует создание комплексных соединений между антитромбином III и такими факторами свертывания крови, как тромбин, факторы XIIa, XIa, Xa, IXa и VIIa. В таком комплексе факторы свертывания необратимо деактивируются.
Для целей получения плазмы крови в пробирки добавляют литиевую либо натриевую соль гепарина в пропорции к забираемой в пробирку кровью 15-20 МЕ/1 мл, что служит гарантией полной инактивации свертывания крови и не искажает исследуемые параметры. Эритроциты сохраняются в образце крови до 8 часов. Нельзя использовать для проведения анализов образец крови, хранившийся более 48 часов даже в условиях холодильника (+4ºС).
Для получения качественного анализа необходимо немедленно после взятия крови осторожно перевернуть пробирку 5-7 раз для лучшего перемешивания крови и гепарина.
Плазма отделяется после центрифугирования. Нормальные скорости центрифугирования – 1 000–1 500 G (2 000–3 000 оборотов/минуту).
При необходимости допускается центрифугирование с ускорением 4 000 G c крышечкой и до 12 000 G без крышечки.
В клинике пробирки с гепарином применяются, в основном для проведения исследования электролитного состава крови, газового состава крови и содержания алкоголя в крови.
Не рекомендуется использовать гепарин для:
- морфологических исследований, так как кислотный характер гепарина способствует обесцвечиванию мазка крови, придавая ему голубоватый оттенок;
- подсчета лейкоцитов и тромбоцитов, поскольку гепарин стимулирует агрегацию этих клеток крови;
- исследований по методике полимеразной цепной реакции (ПЦР).
Для более чистого разграничения плазмы крови и сгустка применяются специальные пробирки, содержащие кроме гепарина инертный олефиновый гель. Последний представляет собой тиксотропный кополимер, который тяжелее плазмы, но легче форменных клеток крови, поэтому после центрифугирования гель в виде тонкой полоски занимает промежуточное положение и служит разделительным барьером.
Фторид натрия/ЭДТА калия (серая крышка пробирки)
Добавление фторида натрия и ЭДТА калия в пробирку позволяет предотвратить разрушение глюкозы крови (процесс, называемый гликолизом) и сохранить ее уровень во взятом образце крови.
Фторид натрия и оксалат калия выступают в качестве антикоагулянтов, связывая ионы Са2+ и, кроме того, фторид натрия стабилизирует уровень глюкозы.
Глюкоза разрушается до пирувата и лактата при последовательном осуществлении различных энзиматических реакций. Фторид натрия ингибирует некоторые ферментативные реакции, включая превращение фосфоглицерата в фосфоенолпируватацид, и предотвращает гликолиз.
Для получения качественного результата анализа необходимо немедленно после взятия крови осторожно перевернуть пробирку 5-7 раз для лучшего перемешивания крови и антикоагулянта.
Плазма отделяется после центрифугирования. Нормальные скорости центрифугирования — 1 000–1 500G (2 000–3 000 оборотов/минуту).
Пробирки с добавлением фторида натрия и оксалата калия используют для проведения определения уровня сахара (глюкозы) в крови. Соотношение компонентов 1/1, общее количество добавляемых реагентов – 4,5 мг/1 мл забираемой в пробирку крови.
Важное про фторид натрия и ЭДТА калия:
- Фторид блокирует активность уреазы и некоторых других ферментов.
- Образцы крови из данных пробирок нельзя использовать для прямого определения энзимов.
- Фторид натрия и ЭДТА калия связывают ион Са2+, заменяя в крови 1 ион кальция на 2 иона натрия или калия.
- Следствием этого является повышение напряжения ионов в межклеточной жидкости и выкачивание воды из внутриклеточного пространства в межклеточное, сморщивание клеток крови с умеренным “выдавливанием” из эритроцитов гемоглобина. Поэтому видимый гемолиз свойственен образцам крови с данной добавкой.
- Глюкоза превращается в лактат в результате комплекса реакций, включающего в себя различные этапы. Фторид ингибирует один их последних этапов разрушения глюкозы, начальные этапы с участием гексокиназы и фосфофруктокиназы блокируются менее эффективно, поэтому можно наблюдать снижение содержания глюкозы в образце крови на 6-7% от первоначального.
- После первоначального незначительного снижения уровня глюкозы ее количество остается постоянным при хранении крови в пробирке в течение 8-10 часов при температуре до 25ºС и в течение 2-3 дней в холодильнике (+4ºС).
ЭДТА-К2 (сиреневая крышка)
Этилендиаминтетраацетат (ЭДТА) является предпочтительным антикоагулянтом для гематологических исследований. ЭДТА и его щелочные соли способны создавать хелатные соединения с ионами кальция с образованием растворимых высокостабильных комплексов.
Наиболее эффективная концентрация ЭДТА – 1,2 мг/мл крови. Во всем мире используют три варианта солей ЭДТА: ЭДТА-К3, ЭДТА-К2 и ЭДТА-Na2.
Наиболее предпочтительной и рекомендуемой Международной Комиссией по Стандартизации в Гематологии является двукалиевая соль ЭДТА:
ЭДТА-К3 показывает меньшую способность поддержания крови в жидком состоянии, также ЭДТА-К3 влияет на подсчет лейкоцитов, занижая их количество.
Различия между ЭДТА-К2 и ЭДТА-Na2 в клиническом плане незначительны и ими можно пренебречь, но ЭДТА-Na2 хуже растворим.
Для получения качественного результата анализа необходимо немедленно после взятия крови осторожно перевернуть пробирку 5-7 раз для лучшего перемешивания крови и антикоагулянта.
Плазма отделяется после центрифугирования. Нормальные скорости центрифугирования — 1 000-1 500 G (2 000–3 000 оборотов/минуту).
При необходимости допускается центрифугирование с ускорением 4 000 G c крышечкой и до 12 000 G без крышечки.
Наиболее широко используются пробирки, содержащие 1,95 мг ЭДТА/1мл крови. Они нашли свое применение в таких областях лабораторной практики, как:
- гематологические исследования – подсчет клеток крови, определение СОЭ и пр. ;
- ПЦР-исследования (качественные и количественные методики).
Пробирки с образцами крови можно хранить до 6-10 часов при 4ºС, хранение свыше 24 часов не рекомендуется из-за снижения числа эритроцитов и лейкоцитов.
Цитрат натрия (голубая крышка)
Цитрат натрия является антикоагулянтом для сбора венозной крови с це6лью проведения исследований коагуляционных свойств крови.
Процесс свертывания крови представляет собой последовательность сложных реакций, в которых результатом первых реакций (с участием активных ферментов) является активация следующих, первоначально неактивных энзимов.
Последним активным ферментом в этой цепочке присутствует тромбин, который осуществляет превращение фибриногена в фибрин. Нити фибрина опутывают клетки крови и окончательно формируют кровяной сгусток. Крайне важную роль на этом этапе играют ионы Са2+.
Антикоагуляционные свойства цитрата проявляются в формировании комплекса с ионами Са2+ и эффективном удалении их из крови.
Общее исследование свертывания крови определяется временем, необходимым для последовательной активации ферментов, участвующих в коагуляционном процессе. Проводится определение времени активации и количественное измерение различных составляющих коагуляционного каскада, для чего создаются так называемые “обходные пути” добавлением некоторых промежуточных продуктов свертывания.
Наиболее часто используются пробирки с 3,8% или 3,2% раствором цитрата натрия (0,129 моль/л), соотношение цитрата к количеству забираемой крови 1/9.
Для максимально качественного проведения коагулологических исследований рекомендуется соблюдение определенных правил:
- нельзя использовать пробирку для взятия крови на коагуляционные тесты первой, сразу после венепункции, так как на результаты может повлиять выделяющийся при пункции тканевой тромбопластин;
- венозный жгут во время взятия крови в пробирку должен быть снят;
- немедленно после взятия крови пробирку аккуратно переворачивают 5-6 раз для лучшего перемешивания крови и антикоагулянта;
- сразу после этого надо проверить количество взятой крови: ее верхняя граница должна быть на уровне голубой полоски на этикетке.
Оптимальными условиями хранения пробирки с образцом крови является температура 20-24ºС и исследование коагуляционных свойств и факторов свертывания крови должно быть проведено в течение 2-х часов с момента взятия крови.
Преаналитический этап при исследованиях гемостаза
- Для исследования системы гемостаза разработаны и полущили широкое распространение высокоточные приборы и надежные лабораторные методы, которые позволяют быстро и эффективно выявить нарушения, приводящие к кровоточивости или тромбозам, однако их воспроизводимость и точность значимо снижаются при несоблюдении правил и условий преаналитического этапа. Взятие образцов крови, транспортировку и их подготовку для исследования системы гемостаза следует рассматривать как важнейшие этапы полущения корректных результатов,
- которым должно быть уделено немало внимания в любой лаборатории, выполняющей исследование системы гемостаза.
- ПОДГОТОВКА ПАЦИЕНТА
Кровь для исследования гемостаза забирают утром натощак по прошествии не менее. 8 ч после последнего приема пищи. Важно, чтобы взятие венозной крови проводилось в спокойном состоянии, поэтому перед венепункцией пациенту рекомендуют посидеть в течение 20-30 мин. Для получения надежных результатов при исследовании тромбоцитарного гемостаза за день до сдачи анализа пациенту следует избегать стрессов, физических нагрузок, смены режима дня и изменений в питании, приема алкоголя. Особенно тщательно необходимо соблюдать эти условия при исследовании маркеров активации тромбоцитов (β-тромбоглобулина, тромбоцитарного фактора-4).
Врачу необходимо знать о лекарственных препаратах, которые назначены и вводятся пациент}, поскольку ряд медикаментов способны нарушить агрегацию тромбоцитов или вызвать изменение параметров коагуляции.
В подобных ситуациях часто приходится учитывать лишь антикоагулянтный или антитромбоцита р- ный эффект применяемых лекарственных препаратов, поскольку выявить многие нарушения гемостаза на фоне применения антикоагулянтов или антиагрегантов невозможно.
У пациентов в реанимационном отделении нельзя брать кровь из подключичного катетера, поскольку это наиболее частая причина попадания гепарина в образец крови. У пациентов в отделении гемодиализа нельзя осуществлять забор крови из артериовенозной фистулы.
Однако при некоторых критических состояниях взятие крови в пробирку или вакутейнер из кубитальной вены бывает невозможно из-за снижения давления.
В подобных ситуациях кровь для исследования допустимо взять из подключичного катетера, но при этом следует учитывать, что перечень выполняемых методик будет существенно ограничен вследствие возможного наличия гепарина в образце.
АНТИКОАГУЛЯНТЫ
Цитрат натрия
Цитрат натрия связывает ионы кальция и останавливает реакции свертывания. В качестве антикоагулянта для определения большинства показателей коагуляционного и тромбоцитарного звеньев системы гемостаза следует использовать 0,105-0,109 M раствор лимоннокислого натрия, который готовят растворением 3.
1-3,2 г Na3C6H507х2H2O в 100 мл воды. Этот раствор следует хранить при температуре от +2 до +8 0C не более 48 ч.
При несоблюдении температурного режима в таком растворе развивается микрофлора, вследствие чего концентрация цитрата натрия уменьшается и появляются посторонние примеси, обладающие потенциальной способностью стимулировать тромбоциты и активировать коагуляционные реакции.
При наличии рекомендации фирм-производителей реагентов допустимо применение 0,129 M (3,8%) цитрата натрия, однако следует учитывать, что разные концентрации стабилизатора по-разному влияют на ряд показателей коагуляции, в том числе и на МНО. Такое влияние особенно заметно при сравнении реагентов разных производителей.
Этилендиаминтетраацетат
ЭДТА также связывает кальций, останавливая свертывание.
Соли этилендиа- минтетраацетата используют для стабилизации образцов, предназначенных для определения клеточного состава периферической крови на гематологических анализаторах.
K2-, K3- и Na2-соли ЭДТА в концентрации 1,2-2,0 мг/мл применяют также при дальнейшем исследовании методами ИФА и ПЦР. Недопустимо использование ЭДТА для исследования коагуляции и функциональной способности тромбоцитов.
Гепарин
Гепарин активирует плазменный антитромбин, который необратимо связывает ферментные факторы свертывания.
Этот антикоагулянт традиционно применяют в ИФА; как правило, для стабилизации крови необходимо от 12 до 30 ЕД/мл натриевой, калиевой или литиевой соли нефракционированного гепарина.
При получении плазмы для исследования ее коагуляционных свойств и функциональной способности тромбоцитов этот антикоагулянт применять нельзя.
ПРОБИРКИ
При взятии и подготовке образцов крови для исследования гемостаза следует применять меры для предупреждения активации тромбоцитов и коагуляционных реакций. Для образцов крови нельзя использовать обычные стеклянные пробирки. поскольку стекло активирует коагуляцию и сорбирует коагуляционные факторы.
В течение многих лет для предупреждения этих эффектов использовали силиконирование пробирок, однако появились сведения о недостаточной способности некоторых силиконов предупреждать активацию тромбоцитов. Кроме того, эта процедура трудно стандартизируется и занимает дополнительное время.
Как альтернативу силиконированию следует использовать пластиковые пробирки, однако различные сорта пластика также разнятся по способности активировать коагуляционные реакции.
Хорошие результаты дает использование вакуумных систем для взятия крови, содержащих забуференный 3,2% раствор цитрата натрия (буферизация чаще достигается добавкой лимонной кислоты).
Цветовая кодировка по ISO/DIS 6710 для вакуумных систем, содержащих цитрат натрия, предусматривает светло- голубой или зеленый цвет колпачков; для пробирок с ЭДТА — лиловый или красный; для пробирок с гепарином — зеленый или оранжевый.
Существуют данные о хороших результатах использования специальных CTAD-систем (со стабилизатором, включающим цитрат натрия, трифосаденин, теофиллин и дипиридамол) для определения β-тромбоглобулина, тромбоцитарного фактора-4, PAI-1, контроля гепаринотерапии по АЧТВ или анти-Ха, определения МНО. Однако этот стабилизатор непригоден для исследования функциональной способности тромбоцитов.
ОПТИМАЛЬНОЕ СООТНОШЕНИЕ ЦИТРАТ/КРОВЬ
Поскольку большинство факторов свертывающей системы содержится в плазме, но не в эритроцитах, необходимое количество антикоагулянта зависит от показателя гематокрита у пациента.
Для стабилизации образцов крови при значении гематокрита в нормальном диапазоне (от 35 до 50%) принято смешивать один объем 3,2% раствора цитрата натрия с девятью объемами крови.
При отклонениях гематокрита от указанных величин следует изменить это соотношение в соответствии с формулой Ingram:
- X = V × (100 — НСТ) / (595 — НСТ),
- где X — добавляемый объем 3,2% цитрата, мл; V — конечный объем пробирки для крови, мл; HCT — показатель гематокрита у пациента, %.
- ТЕХНИКА ВЕНЕПУНКЦИИ
- ИГЛА И ПРОБИРКА
Для получения образцов венозной крови необходимо привлекать наиболее опытных и квалифицированных процедурных медсестер, способных в течение нескольких секунд пунктировать вену с наименьшими травматичностью и болезненностью для пациента.
Медсестре необходимо внимательно ознакомиться с направлением на исследование, выбрать пробирки, определить корректную последовательность их наполнения, промаркировать их и указать время взятия крови.
В некоторых специализированных лабораториях на время взятия крови в помощь процедурной медсестре направляют лабораторного техника, что позволяет значительно увеличить пропускную способность процедурного кабинета, снизить вероятность ошибок дозирования цитрата при сдвигах гематокрита и неточностей маркировки проб.
Образец крови предпочтительнее брать из кубитальной вены; место прокола обрабатывают 70% спиртом и дают высохнуть. Допустимо лишь кратковременное (не более 60 с) наложение жгута на плечо, поскольку при венозном стазе происходит активация фибринолиза; после введения иглы в вену жгут тотчас же расслабляют или удаляют.
Наилучшие результаты (с учетом травматичности, болезненности, универсальности, скорости наполнения пробирок) дает использование иглы с калибром 21G. Желательно не брать для исследования гемостаза первые 2-3 мл крови, поэтому их набирают в пробирку без антикоагулянта и используют, например, для получения сыворотки (биохимические, иммунологические тесты и др.).
Далее пластиковые или силиконированные пробирки с предварительно добавленным цитратом наполняют кровью из иглы самотеком, сразу же закрывают и перемешивают путем 4-6-кратного переворачивания или вращения (без встряхивания).
В связи с использованием игл увеличенного диаметра после венепункции в большинстве ситуаций руку пациента необходимо перебинтовать 2- 4 оборотами бинта, приложив к месту прокола марлевый тампон с 70% спиртом.
Наполнять пробирки с цитратом с помощью шприцев для инъекций нельзя, поскольку при насасывании крови и ее последующем переносе в пробирку происходит активация тромбоцитов и коагуляционных факторов вследствие контакта крови с пластиком шприца и дополнительного вспенивания, обусловленного турбулентным движением крови в шприце.
СПЕЦИАЛИЗИРОВАННЫЕ ВАКУУМНЫЕ СИСТЕМЫ
Стандартом для клинических лабораторий, в которых исследуют показатели гемостаза, считается использование одноразовых вакуумных систем (вакутейнеров и др.), содержащих 3,2% раствор цитрата натрия.
Их использование в значительной степени ускоряет, стандартизирует процедуру взятия крови и позволяет существенно снизить разброс результатов.
Если кровь для исследования показателей гемостаза берут через катетеры или системы с иглой-бабочкой, необходимо обеспечить полную герметичность системы и предварительное заполнение кровью всех «мертвых» объемов — просвета самого катетера, иглы и переходника, иначе возможны частичная потеря вакуума и неполное заполнение пробирки. Для предотвращения этого, а также попадания кусочков поврежденных тканей кровь для анализа показателей гемостаза не рекомендуют брать в первую вакуумную пробирку.
В условиях выраженного сгущения крови (полицитемии, дегидратации и др.) стандартное количество цитрата в вакуумных системах оказывается избыточным для уменьшенного объема плазмы.
При использовании вакуумных пробирок и уровне гематокрита у пациента выше 50% часть раствора цитрата из пробирки следует предварительно отсосать (например, с помощью инсулинового шприца).
Подлежащий удалению из стандартной вакуумной пробирки объем цитрата можно определить по формуле:
- Y = (V / 10) × (9 × HCT — 405) / (595 — НСТ),
- где Y — подлежащий удалению объем цитрата, мл; V — конечный объем пробирки для крови, мл; HCT — показатель гематокрита у пациента, %.
- При низком (