При развитии сосудистых нарушений возникает сопутствующая патология, которая ности название гемоглобинурия. Об этом заболевании, его причинах, осложнениях и методах диагностики рассказывается далее.
Что это за патология
Гемоглобинурия — это понятие, которое объединяет в себе несколько форм гемолитической анемии.
Причины их развития кроются во внутрисосудистом повреждении эритроцитов с последующим выходом гемоглобина в урину и за пределы сосудистого русла.
Характерным проявлением заболевания считается темный цвет урины, а для постановки точного диагноза проводятся различные исследования. Повышенный гемоглобин по МКБ-10 классифицируется как D50.
У каждой разновидности гемолитической анемии этиология разная, но общим фактором для них служит внезапно возникший внутрисосудистый гемолиз. Он характеризуется проникновением в плазму крови гемоглобина и преодолением почечного барьера.
Виды и классификация
Существует несколько видов внутрисосудистого гемолиза с гемоглобинурией.
Для ПНГ характерны частые приступы внутрисосудистого гемолиза и чаще всего по ночам. Кризы часто вызывают сильные переохлаждения организма, различные инфекционные агенты, повышенные физические нагрузки, операции и гемотрансфузии.

Маршевая гемоглобинурия характеризуется появлением стертых симптомов и постепенным развитием. При такой форме патологии не наблюдается подъем температуры тела и озноба. Пациент может жаловаться на постоянную усталость, которая становится результатом общего физического утомления.
Одновременно с этим характерным проявлением маршевой гемоглобинурии становится заметное потемнение мочи. При отсутствии маршевой нагрузки урина заметно светлеет, а самочувствие пациента улучшается.
Холодовая пароксизмальная гемоглобинурия считается достаточно редкой формой патологии, которая протекает приступообразно. Причиной такой болезни служит переохлаждение организма, и дополняется она гипертермией. Кроме этого, пациент может жаловаться на сильный озноб, приступы тошноты, рвоту и абдоминальные болевые ощущения.
Пароксизмальная холодовая гемоглобинурия, спровоцированная вирусными инфекциями в острой форме, исчезает одновременно с основной болезнью. При наличии у больного сифилиса и малярии такая разновидность может сохраняться в течение продолжительного времени.
Выделяют как однократную, так и повторяющуюся гемоглобинурию.
Причины возникновения
Основной причиной развития у человека ПНГ становится дефект мембран эритроцитов, что делает их особенно уязвимыми перед сывороточным комплементом.
При создании подходящих условий происходит их стремительное разрушение. При такой форме болезни определенная часть лейкоцитов имеет поврежденные мембраны.
Специалисты утверждают, что первичной причиной возникновения ПНГ становится аномальный клон общей клетки, которая является предшественницей миелопоэза при соматической мутации.
Токсическая гемоглобинурия может развиваться у человека при попадании в организм ядов после укусов животных и насекомых. Кроме этого, такая форма болезни развивается как результат отравления организма такими вредными токсинами, как различные химикаты, медикаментозные средства и ядовитые грибы.
Причиной токсической гемоглобинурии у пациентов может становится переливание несовместимой крови.
Причиной прогрессирования маршевой гемоглобинурии служат слишком тяжелые беговые нагрузки и ходьба в течение длительного времени. Преимущественно такая форма патологии выявляется у физически здоровых лиц, спортсменов и солдат.
Причиной холодовой пароксизмальной гемоглобинурии считается переохлаждение организма в течение длительного времени. Кроме этого, спровоцировать болезнь могут инфекционные заболевания.
Переходящая гемоглобинурия может диагностироваться у пациентов, принимающих железосодержащие лекарственные препараты.
Механизм развития болезни и локализация
У здоровых людей в сосудистом русле осуществляется распад незначительного количества эритроцитов, а концентрация в плазме достигает 1-4 мг гемоглобина. Его избыточное количество соединяется с гаптоглобином и образуется комплекс гемоглобин-гаптоглобин.
Он не способен преодолевать почечный барьер. За счет такого механизма удается не допустить появления гемоглобинурии и гемосидероза почек. В том случае, если возникает массивный распад эритроцитов, то гемоглобин проникает через почечный барьер и проникает в мочу.
Возможные осложнения
Гемоглобинурия является опасной патологией, которая может вызывать множественные осложнения. Самым неприятным последствием ночной пароксизмальной гемоглобинурии как симптома становится тромбоз почечных и брыжеечных сосудов, а также печеночных вен.
При поражении печеночных вен отмечается существенное увеличение органа, варикоз пищеводных вен и асцит.
При постоянной гемосидеринурии высока вероятность возникновения канальцевого нефрита. На пике гемолитического криза у больного может отмечаться почечная недостаточность в острой форме.
Проявления
Приступы ПНГ у взрослых характеризуются следующими признаками:
- лихорадка;
- болевой синдром в суставах, поясничной области, животе и за грудной клеткой;
- постоянное желание спать.
Характерным симптомов патологии считается окрашивание мочи в темный цвет. При маршевой гемоглобинурии больной может жаловаться на постоянную слабость организма и изменение окраски урины.
При холодовой пароксизмальной гемоглобинурии приступы дополняются спленомегалией, ознобом, приступами тошноты и рвоты. Кроме этого, могут беспокоить болевые ощущения в животе, изменяется окраска мочи, кожные покровы и склеры окрашиваются в желтый цвет.

Диагностика
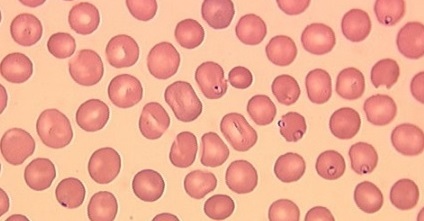
Основным признаком патологии считается изменение цвета мочи. Она может быть коричневого, темно-красного цвета. При отстаивании урина разделяется на верхний и нижний слой, в котором содержится примесь в виде детрита.
Подтвердить наличие у пациента патологии удается по результатам проведенных лабораторных тестов.
Для постановки точного диагноза ПНГ могут проводиться следующие исследования:
Оценить состояние кроветворения возможно по результатам пункции костного мозга и изучения миелограммы.
Кто в группе риска
В группу риска по развитию патологии попадают люди, страдающие:
- гемолитической анемией;
- синдромом Бадда-Киари;
- тромбозами атипичной локализации;
- поражениями церебральных и кожных вен.
Кроме этого, риск развития гемоглобинурии повышается у людей с эпизодами дисфагии либо болевого синдрома в животе, а также симптомами внутрисосудистого гемолиза.
Гемоглобинурия считается опасным заболеванием, которое характеризуется окрашиванием мочи в темный цвет. Однако, некоторые формы болезни успешно поддаются лечению.
Материал подготовлен специально для сайта venaprof.ru под редакцией врача Глушаковой Н.А.
Специальность: терапия, кардиология, семейная медицина
Гемоглобинурия

Гемоглобинурия – ряд синдромов, в основе которых лежит внутрисосудистое повреждение эритроцитов с выходом гемоглобина за пределы сосудистого русла и в мочу. Основным симптомом гемоглобинурии является темная окраска мочи из-за присутствующего в ней оксигемоглобина. Возможны артралгии, лихорадочное состояние, рвота, бледность кожных покровов, желтуха. Диагноз гемоглобинурии требует подтверждения с помощью исследования общего анализа крови и мочи, миелограммы, проведения функциональных и лабораторных проб. С учетом патогенетической формы гемоглобинурии может быть показано переливание эритроцитов, применение гормонов, антикоагулянтов, проведение спленэктомии, ТКМ.
Понятием «гемоглобинурия» объединяются некоторые формы гемолитической анемии, протекающие с внутрисосудистым гемолизом эритроцитов и появлением в моче свободного гемоглобина.
К ним относятся пароксизмальная ночная гемоглобинурия (болезнь Маркиафавы-Микели), токсическая, маршевая и холодовая пароксизмальная гемоглобинурия.
Эти состояния, различные по этиологии, объединяет массивный, остро развившийся внутрисосудистый гемолиз, сопровождающийся выходом гемоглобина в плазму крови и преодолением почечного барьера. В гематологии различают однократную (симптоматическую) и повторяющуюся (пароксизмальную) гемоглобинурию.
У здоровых лиц в сосудистом русле происходит распад примерно 10% эритроцитов, а в плазме содержится 1-4 мг% гемоглобина. При этом избыток гемоглобина связывается специфическим белком гаптоглобином с образованием крупномолекулярного комплекса гемоглобин-гаптоглобин, не преодолевающим почечный барьер.
Этот механизм предотвращает возникновение гемоглобинурии и гемосидероза почек. Однако при внезапном массивном распаде эритроцитов либо гипогаптоглобинемии, приводящей к снижению гемоглобинсвязывающей способности плазмы, гемоглобин преодолевает почечный фильтр и оказывается в моче.
При нормальном содержании гаптоглобина гемоглобинурия развивается при концентрации гемоглобина в плазме, превышающей 125-135 мг%.

Гемоглобинурия
В основе различных форм гемоглобинурии лежат свои причинно-значимые факторы.
Так, пароксизмальная ночная гемоглобинурия развивается вследствие дефекта мембран эритроцитов, в результате чего последние становятся уязвимы перед комплементом сыворотки и при определенных условиях легко разрушаются.
Поскольку часть лейкоцитов и тромбоцитов в этом случае также имеют дефектные мембраны, считается, что первичным звеном пароксизмальной ночной гемоглобинурии служит появление в результате соматической мутации аномального клона общей клетки-предшественницы миелопоэза.
Токсическая гемоглобинурия может являться следствием укусов ядовитых насекомых и животных, а также отравления различными веществами: химическими соединениями, лекарственными препаратами (сульфаниламидами), несъедобными грибами.
Гемоглобинурия может являться посттрансфузионным осложнением при переливании крови, несовместимой по групповой или резус-принадлежности. Маршевая гемоглобинурия развивается после многокилометровых переходов (маршей) или беговых нагрузок.
Такая форма гемоглобинурии обычно диагностируется у физически здоровых лиц, чаще – у солдат, спортсменов, путешественников. В данном случае разрушение эритроцитов провоцируется нагрузкой на стопы, однако данный феномен, открытый еще в годы Первой мировой войны, до сих пор не имеет научного объяснения.
Предположительно, длительное и грубое механическое раздражение подошвенной части стопы первоначально вызывает гемолиз эритроцитов в капиллярах данной области, а затем распространяется на все сосудистое русло.
Холодовая пароксизмальная гемоглобинурия может развиваться вследствие длительного охлаждения организма (купания в холодной воде, пребывания на холодном воздухе), а также инфекционных заболеваний (гриппа, паротита, кори, инфекционного мононуклеоза, малярии, сифилиса, анаэробного сепсиса). Для данной формы характерно появление в крови двухфазных гемолизинов Доната-Ландштейнера, вызывающих активацию комплемента и внутрисосудистый гемолиз.
Известны другие формы гемоглобинурии — алиментарно-токсическая пароксизмальная миоглобинурия (гаффская болезнь), травматическая гемоглобинурия при краш-синдроме и пр. Преходящая гемоглобинурия встречается у пациентов, принимающих железосодержащие препараты.
Отличительной особенностью пароксизмальной ночной гемоглобинурии (болезни Маркиафавы-Микели) служат приступы внутрисосудистого гемолиза (гемолитические кризы), развивающиеся преимущественно в ночное время.
Заболевание регистрируется с частотой 1:500000. Гемолитические кризы могут провоцироваться переохлаждением, инфекцией, вакцинацией, гемотрансфузиями, физическими нагрузками, хирургическими вмешательствами.
Пароксизмы гемолиза эритроцитов сопровождаются лихорадочным состоянием, артралгиями, сонливостью, болями за грудиной, в животе и пояснице.
Признаком нарастающей железодефицитной анемии служат общая слабость, желтушность кожных покровов и слизистых оболочек. Характерно увеличение печени и селезенки.
Выделение мочи темного цвета отмечается только у четверти пациентов с пароксизмальной ночной гемоглобинурией.
Наиболее опасными проявлениями пароксизмальной ночной гемоглобинурии служат тромбозы брыжеечных сосудов, сосудов почек, периферических сосудов.
Тромбоз печеночных вен сопровождается резким увеличением размеров печени, прогрессирующим асцитом, варикозным расширением вен пищевода.
Постоянная гемосидеринурия часто приводит к возникновению канальцевого нефрита; на высоте гемолитического криза может развиться острая почечная недостаточность.
Пароксизмальная ночная гемоглобинурия нередко развивается у пациентов с апластической анемией, предлейкозом или острым миелоидным лейкозом, поэтому требует проведения полного гематологического обследования больного.

Утренняя гематурия обнаруживается в моче у пациентов с пароксизмальной ночной гемоглобинурией
Маршевая гемоглобинурия
Симптоматика маршевой гемоглобинурии обычно более стертая и развивается постепенно. Озноб и повышение температуры нехарактерны.
Отмечается слабость, которая также может быть следствием общего физического утомления от марш-броска. Вместе с тем, патогномоничным признаком данной формы гемоглобинурии является темная окраска мочи.
После прекращения маршевой нагрузки самочувствие нормализуется, моча светлеет.
Замечено, что практически у всех лиц, столкнувшихся с маршевой гемоглобинурией, имеется выраженный поясничный лордоз. Самостоятельного клинического значения данная форма гемоглобинурии не имеет.
Холодовая пароксизмальная гемоглобинурия
Редкая форма гемолитической анемии — пароксизмальная холодовая гемоглобинурия протекает приступообразно. Пароксизмы холодовой гемоглобинурии обычно провоцируются переохлаждением и сопровождаются гипертермией (иногда до 40°С), потрясающими ознобами, тошнотой и рвотой, абдоминальными болями. Выявляется гепато- и спленомегалия, желтоватый цвет кожи и склер, характерная окраска мочи.
Пароксизмальная холодовая гемоглобинурия, вызванная острыми вирусными инфекциями, обычно разрешается вместе с основным заболеванием. При сифилисе и малярии заболевание может длиться годами.
Основным макроскопическим признаком гемоглобинурии служит изменение цвета и структуры собранной мочи. Цвет мочи может быть темно-красным, коричневым или почти черным.
При отстаивании моча отчетливо разделяется на 2 слоя: верхний – прозрачный и нижний – содержащий примесь в виде детрита.
Лабораторными тестами, подтверждающими гемоглобинурию, служат проба с сульфатом аммония, обнаружение гемосидерина в осадке, исследование мочи методом электрофореза или иммуноэлектрофореза.
Для уточнения общей картины крови исследуется гемограмма. С целью выявления компонентов комплемента или антител, фиксированных на поверхности эритроцитов, проводится проба Кумбса.
Показано исследование коагулограммы, биохимических показателей крови (билирубина, мочевины, щелочной фосфатазы и др.).
Для оценки состояния кроветворения, особенно в случае панцитопении при пароксизмальной ночной гемоглобинурии, требуется проведение пункции костного мозга и исследование миелограммы.
Гемоглобинурию необходимо отличать от гематурии и заболеваний, для которых она характерна (камней в почках, острого гломерулонефрита), порфирии, аутоиммунной гемолитической анемии, апластической анемии.
Лечебная тактика при различных формах гемоглобинурии определяется гематологом. Маршевая и пароксизмальная холодовая гемоглобинурия обычно разрешаются без специального вмешательства. В случае развития хронической аутоиммунной холодовой гемоглобинурии назначаются глюкокортикоиды и иммунодепрессанты (циклофосфамид, азатиоприн).
Терапия пароксизмальной ночной гемоглобинурии в основном симптоматическая: трансфузии эритроцитов, введение непрямых антикоагулянтов, прием препаратов железа.
При гипоплазии красного костного мозга назначаются глюкокортикостероиды (преднизолон), анаболические препараты (метандиенон) или андрогены, антитимоцитарный иммуноглобулин. При выраженном гиперспленизме может быть оправдана спленэктомия.
При отсутствии эффекта от других методов лечения пароксизмальной ночной гемоглобинурии решается вопрос о пересадке костного мозга, от совместимого по HLA-системе донора.
С целью предотвращения развития гемоглобинурии рекомендуется избегать провоцирующих факторов: отравлений, интоксикаций, инфекционной заболеваемости, чрезмерных физических нагрузок, травм и пр.
Гемолитическая анемия
Гемолитическая анемия — что это такое, клинические рекомендации и способы лечения Гемолитическая анемия (ГА) – это ряд редких, но поддающихся диагностике и лечению болезней крови, во время которых начинается усиленное разрушение эритроцитов. ГА, которые обусловлены внутрисосудистой деструкцией, появляются в результате действия токсинов, сильных ожогов, заражении крови, переливании неподходящей по группе и резусу крови. Влияют и иммунопатологические процессы.
ГА со внесосудистой (внутриклеточной) деструкцией, обладает наследственной природой. Разрушение эритроцитов проходит чаще в макрофагах селезенки, реже в костном мозге, печенке и лимфоузлах. Вероятно трио: анемия, воспаление селезенки и желтуха. ГА делятся на эритроцитопатии, эритроцитоферментопатии и гемоглобинопатии.
Что это такое?
Гемолитическая анемия — групповое название достаточно редко встречающихся заболеваний, общим признаком которых является усиленное разрушение эритроцитов, обусловливающее, с одной стороны, анемию и повышенное образование продуктов распада эритроцитов, с другой стороны — реактивно усиленный эритропоэз.
Немного про эритроциты
Эритроциты, или красные кровяные тельца – это клетки крови, главная функция которых заключается в транспортировке к органам и тканям кислорода.
- Формируются эритроциты в красном костном мозге, откуда зрелые формы их выходят в кровоток и циркулируют по организму. Продолжительность жизни эритроцитов равна 100-120 дням. Каждый день часть их, составляющая примерно 1%, погибает и замещается таким же количеством новых клеток.
- Если продолжительность жизни красных кровяных телец сокращается, в периферической крови или в селезенке их разрушается больше, нежели успевает созревать в костном мозге – равновесие нарушается. Организм реагирует на снижение содержания эритроцитов в крови усиленным синтезом их в костном мозге, активность последнего существенно – в 6-8 раз – возрастает.
В результате в крови определяется повышенное число молодых клеток-предшественников эритроцитов – ретикулоцитов. Разрушение эритроцитов с выделением гемоглобина в плазму крови называют гемолизом.
Причины возникновения
Современная наука не предусматривает деление гемолитической анемии в зависимости от места разрушения эритроцитов. В большей степени уделяя внимание этиологии и патогенезу заболевания и, исходя из этих принципов, болезнь делят на 2 основных класса:
- Приобретенные формы ГА, которые классифицируют по фактору, разрушающему эритроциты и вызывающему эту анемию (антитела, гемолитические яды, механическое повреждение).
- Наследственные гемолитические анемии — классифицируются по принципу локализации генетического дефекта красных кровяных телец, из-за которого эритроциты становятся неполноценными, функционально неустойчивыми и не способными жить положенное для них время. В числе наследственных ГА значатся: мембранопатии (микросфероцитоз, овалоцитоз) дефекты ферментов (дефицит Г-6-ФДС), гемоглобинопатии (серповидно-клеточная анемия, талассемия).
Большое количество всех ГА попадает на приобретенные формы, но и среди них существует ряд вариантов, которые, в свою очередь, тоже имеют разновидности, обусловленные отдельными причинами возникновения:
- Развитие гемолитической анемии может запустить дефицит витамина Е;
- ГА развивается по причине соматических мутаций, изменяющих мембранную структуру красных кровяных телец (пароксизмальная холодовая ночная гемоглобинурия);
- Развитие болезни обусловлено влиянием антиэритроцитарных антител, выработанных на собственные антигенные структуры эритроцитов (аутоиммунные – аутоиммунная гемолитическая анемия) или изоантител, попавших в кровь извне (изоиммунная – гемолитическая болезнь новорожденных);
- Негативное влияние на мембранные структуры нередко оказывают различные химические вещества, чужеродные для человеческого организма (органические кислоты, гемолитические яды, соли тяжелых металлов и др.);
- К повреждению мембраны красных клеток крови может привести механическое воздействие искусственных сердечных клапанов или травмирование эритроцитов в капиллярных сосудах стоп при ходьбе и беге (маршевая гемоглобинурия);
- Такой паразит, как малярийный плазмодий, проникающий в кровь человека при укусе комара (самки) рода Anopheles (малярийный комар), опасен в плане возникновения гемолитической анемии, как симптома «болотной лихорадки».
Самой распространенной формой среди приобретенных ГА является аутоиммунная гемолитическая анемия (АИГА).
Классификация
Все гемолитические анемии классифицируются по такому принципу.
Приобретенные формы – развиваются под определенным влиянием каких-либо внешних факторов, которые оказывают разрушающее воздействие на эритроциты.
- Аутоиммунная гемолитическая анемия;
- Анемии, вызванные механическими эритроцитарными повреждениями или провоцирующим паразитическим, токсическим воздействием веществ.
Наследственные или врожденные формы – являются результатом воздействия на жизнедеятельность эритроцитов генетически детерминированных отклонений.
- Мембранопатии;
- Гемоглобинопатии (серповидно-клеточная анемия, талассемия и пр.);
- Эритроцитопатии (анемия Минковского-Шоффара);
- Ферментопатии.
Симптомы
Гемолитические анемии выражено проявляются в период кризисов. При вялотекущих процессах симптомы смазаны. Определить конкретный вид патологии можно только при помощи дополнительной диагностики.
К основным симптомам относятся:
| Синдром анемии | проявляется в бледности кожи, слизистых. Сопровождается симптомами нехватки кислорода в виде одышки, головокружения, слабости, усиленного сердцебиения. |
| Синдром желтухи | возрастание концентрации билирубина как продукта распада эритроцитов, выражается желтизной кожных покровов, изменением цвета мочи. |
| Гепатоспленомегалия | увеличение селезенки происходит за счет интенсивного гемолиза, может достигать значительных размеров. Печень менее подвержена изменениям. Но в некоторых случаях наблюдается и ее увеличение, сопровождающееся тяжестью в подреберье. |
Гемолитическая анемия может проявляться дополнительными симптомами в виде:
- болей в животе;
- послабления стула;
- болезненности костей;
- повышенной температуры;
- болей в груди и области почек.
Даже если есть только 2 или 3 из перечисленных симптомов, то это должно послужить поводом для врачебного обследования. Ведь токсичный билирубин при длительном воздействии на ткани и органы может нарушить их функции.
Клинические формы
В клиническом проявлении можно выделить несколько распространенных форм гемолитической анемии:
- Аутоиммунная анемия. Это приобретенное заболевание, сопровождается обширным поражением клеток крови. Основная причина патологии – формирование антител в эритроцитах, которые провоцируют гемолиз. Аутоиммунные гемолитические анемии наблюдаются, если клетки иммунитета воспринимают красные кровяные тельца организма, как чужеродных агентов и стремятся их истребить. Прогноз такого заболевания неблагоприятный, требуется переливание крови или пересадка костного мозга.
- Анемия Минковского-Шоффара (наследственный микросфероцитоз) характеризуется аномальной проницаемостью эритроцитной мембраны, через которую проходят ионы натрия. Заболевание имеет аутосомно-доминантный наследственный характер. Развитие волнообразное: чередование стабильных периодов и гемолитических кризов. Основные признаки: уменьшение осмотической сопротивляемости эритроцитов, преобладание измененных эритроцитов – микросфероцитов, ретикулоцитоз. При сложном течении болезни необходимо хирургическое вмешательство (удаление селезенки).
- Талассемия. Если лечащий врач определяет врожденное заболевание крови талассемия, это следствие нарушенного продуцирования гемоглобина в химическом составе крови. Анемия при отсутствии своевременной терапии только прогрессирует, симптомы нарастают, превращают пациента в инвалида. Такая болезнь по происхождению является врожденной, требует сдачи комплекса анализов, подробного обследования клинического больного, лечения для поддержания периода ремиссии.
- Порфирии относятся к наследственной форме заболевания и обусловлены нарушением формирования порфиринов – составляющих гемоглобина. Первый признак – гипохромия, постепенно проявляется отложение железа, изменяется форма эритроцитов, в костном мозге появляются сидеробласты. Порфирии могут иметь и приобретенный характер при токсическом отравлении. Лечение осуществляется введением глюкозы и гематита.
- Серповидно-клеточная анемия является наиболее распространенным вариантом гемоглобинопатии. Характерный признак: эритроциты принимают серповидную форму, что приводит к застреванию их в капиллярах, вызывающему тромбоз. Гемолитические кризы сопровождаются выделением мочи черного цвета со следами крови, значительным снижением гемоглобина в крови, лихорадкой. В костном мозге обнаруживается большое содержание эритрокариоцитов. При лечении больному вводится повышенное количество жидкости, проводится оксигенотерапия и назначаются антибиотики.
Диагностика
В диагностике гемолитических анемий применяют общий клинический анализ крови (обнаруживается анемия и изменения размеров и формы эритроцитов), биохимический анализ крови (в том числе сывороточный билирубин, АлТ, ЛДГ), сывороточный гаптоглобин, гемосидерин и гемоглобин мочи. Для подтверждения диагноза могут применять пункцию костного мозга (в биоптате определяются активные процессы эритропоэза).
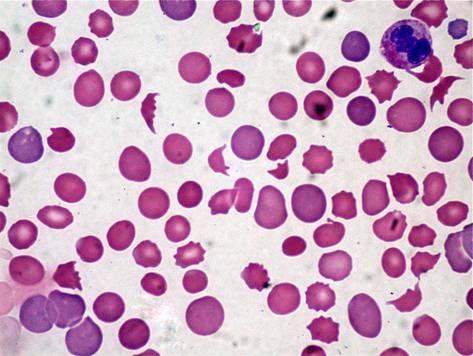
Наиболее характерным для активного интраваскулярного гемолиза является сфероцитоз эритроцитов (при трансфузионных реакциях, наследственном сфероцитозе, при гемолитической анемии с тепловыми антителами).
Могут наблюдаться также шистоцитоз (при интраваскулярном протезировании, микроангиопатиях), серповидные эритроциты (при серповидноклеточной анемии), мишеневидные эритроциты (при патологиях печени, гемоглобинопатиях), ядросодержащие эритроциты и базофилия (при большой бета-талласемии).
Тельца Гейнца обнаруживаются при нестабильном гемоглобине, активации перекисного окисления, акантоциты – при анемии со шпоровидными эритроцитами, агглютинированные клетки – при болезни холодовых агглютининов. [adsen]
Лечение гемолитической анемии
При развитти гемолитической анемии эффективное лечение намного сложнее, чем любых других ее видов. Это связано с тем, что повлиять на механизм запуска гемолиза не всегда возможно. Общий план лечебных мероприятий может включать в себя:
- Гемотрансфузии отмытых эритроцитов. Показано при снижении показателей красной крови до критических цифр;
- Применение препаратов фолиевой кислоты и витамина В12;
- Трансфузии свежезамороженной плазмы и человеческого иммуноглобулина;
- Введение глюкокортикоидных гормонов (дексаметазон, преднизолон, метилпреднизолон, кортинеф);
- Применение цитостатиков. Показано исключительно при аутоиммунной гемолитической анемии;
- Профилактика инфекционных осложнений и обострений имеющейся хронической патологии;
- Оперативное лечение в виде спленэктомии (удаления селезенки). Метод обеспечивает относительно неплохой прогноз на выздоровление. Не эффективен при анемии Минковского-Шоффара и других типах наследственного гемолиза.
Любая гемолитическая анемия, борьба с которой начата несвоевременно – сложная проблема. Недопустимо пытаться справиться с ней самостоятельно. Ее лечение должно быть комплексным и назначается исключительно квалифицированным специалистом на основании тщательного обследования пациента.
Приобретенная гемолитическая анемия
Основной группой препаратов, успешно применяемых в лечении приобретенного малокровия, являются глюкокортикоиды (преднизолон), которые способны полностью блокировать процесс гемолиза.
Но лечение такими гормонами является довольно длительным. Для полной его эффективности требуется безошибочно рассчитанная дозировка препарата.
При неэффективности стероидных гормонов применяются цитостатики.
Если же причину развития гемолитической анемии выявить не удается, то врачи приступают к симптоматическому лечению. Обычно оно заключается в переливании эритроцитарными взвеси пациенту. Особо эффективен этот метод при низком показателе гемоглобина (менее 50) и в периоды гемолитического прогрессирования.
Врожденная или наследственная анемия
Обычно медикаментозное лечение такой анемии дает только временные улучшения общего состояния больного, но рецидивы гемолитических кризов, к сожалению, не предупреждает. Здесь более эффективным будет оперативное вмешательство.
Оно подразумевает проведение спленэктомии – удаление селезенки. Данная операция показала 100%-ную эффективность, пациенты практически полностью излечиваются, хотя патологические свойства эритроцитов и сохраняются. Обычно показанием к операции являются приступы почечных колик, инфаркты селезенки, резкая форма анемии или часто повторяющиеся кризы.
Осложнения и профилактика
- ДВС-синдром;
- анемический шок (острая сердечно-сосудистая недостаточность);
- гемосидероз внутренних органов;
- подкапсульные разрывы, инфаркты селезёнки, гиперспленизм;
- арегенераторный криз;
- острая почечная недостаточность;
- дискинезии желчных путей.
Единственно возможным способом предупредить развитие анемии – ведение здорового образа жизни, своевременное лечение и профилактика других заболеваний.
Приобретенные гемолитические анемии
- Содержание статьи:
- Приобретенные гемолитические анемии развиваются у большинства больных при внутрисосудистом гемолизе нормальных эритроцитов, обусловленном антителами и токсинами, гиперактивностью клеток ретикулоэндотелиальной системы, естественными или механическими препятствиями кровотоку.
Иммунные гемолитические анемии
Иммунный гемолиз у взрослых обычно вызван IgG- и IgM-аутоантителами к антигенам собственных эритроцитов.
При остром начале аутоиммунных гемолитических анемий у больных появляются слабость, одышка, сердцебиение, боли в сердце и в пояснице, повышается температура, развивается интенсивная желтуха.
При хроническом течении заболевания выявляют общую слабость, желтуху, увеличение селезенки, иногда и печени.
Анемия носит нормохромный характер. В крови обнаруживают макроцитоз и микросфероцитоз, возможно появление нормобластов. СОЭ увеличена.
Основной метод диагностики аутоиммунных гемолитических анемий — проба Кумбса, при которой антитела к иммуноглобулинам (особенно IgG) или компонентам комплемента (СЗ) агглютинируют эритроциты больного (прямая проба Кумбса).
В некоторых случаях необходимо выявить антитела в сыворотке больного. Для этого сначала инкубируют сыворотку больного с нормальными эритроцитами, а затем выявляют антитела на них с помощью антиглобулиновой сыворотки (анти-IgG) — непрямая проба Кумбса.
В редких случаях на поверхности эритроцитов не обнаруживают ни IgG, ни комплемент (иммунная гемолитическая анемия с отрицательной пробой Кумбса).
Аутоиммунная гемолитическая анемия с тепловыми антителами
Аутоиммунная гемолитическая анемия с тепловыми антителами чаще развивается у взрослых, особенно у женщин.
Тепловые антитела относятся к IgG, реагирующим с белковыми антигенами эритроцитов при температуре тела.
Эта анемия бывает идиопатической и лекарственной и наблюдается как осложнение гемобластозов (хронического лимфолейкоза, лимфогранулематоза, лимфомы), коллагенозов, особенно СКВ, СПИДа.
Клиника заболевания проявляется слабостью, желтухой, спленомегалией. При выраженном гемолизе у больных появляются лихорадка, обмороки, боли в грудной клетке и гемоглобинурия.
Лабораторные данные характерны для внесосудистого гемолиза. Выявляется анемия со снижением уровня гемоглобин до 60–90 г/л, содержание ретикулоцитов повышается до 15—30%. Прямая проба Кумбса положительна более чем в 98% случаев, обнаруживают IgG в сочетании с СЗ или без него. Уровень гемоглобина снижен. В мазке периферической крови обнаруживается микросфероцитоз.
Легкий гемолиз не требует лечения. При гемолитической анемии средней тяжести и тяжелой — лечение в первую очередь направлено на причину заболевания. Для быстрого прекращения гемолиза используют нормальный иммуноглобулин G 0,5–1,0 г/кг/сут в/в в течение 5 сут.
Против самого гемолиза назначают глюкокортикоиды (например, преднизолон 1 мг/кг/сут внутрь) до нормализации уровня гемоглобина в течение 1—2 недель. После этого дозу преднизолона снижают до 20 мг/сут, затем в течение нескольких месяцев продолжают снижать и отменяют полностью. Положительный результат достигается у 80% больных, но у половины из них заболевание рецидивирует.
При неэффективности или непереносимости глюкокортикоидов показана спленэктомия, которая дает положительный результат у 60% больных.
В отсутствии эффекта от глюкокортикоидов и спленэктомии назначают иммунодепрессанты — азатиоприн (125 мг/сут) или циклофосфамид (100 мг/сут) в сочетании с преднизолоном или без него. Эффективность этого лечения составляет 40—50%.
При тяжелом гемолизе и выраженной анемии проводят гемотрансфузию. Так как тепловые антитела реагируют со всеми эритроцитами, обычный подбор совместимой крови неприменим.
Предварительно следует адсорбировать антитела, присутствующие в сыворотке больного, с помощью его же эритроцитов, с поверхности которых удалены антитела. После этого сыворотка исследуется на наличие аллоантител к антигенам донорских эритроцитов.
Подобранные эритроциты медленно переливают больным под тщательным наблюдением за возможным возникновением гемолитической реакции.
Аутоиммунная гемолитическая анемия с холодовыми антителами
Эта анемия характеризуется наличием аутоантител, реагирующих при температуре ниже 37 °С. Существует идиопатическая форма болезни, составляющая около половины всех случаев, и приобретенная, связанная с инфекциями (микоплазменными пневмониями и инфекционным мононуклеозом) и лимфопролиферативными состояниями.
Основным симптомом болезни является повышенная чувствительность к холоду (общему переохлаждению или приему холодной пищи или напитков), проявляющаяся посинением и побелением пальцев рук и ног, ушей, кончика носа.
Характерны расстройства периферического кровообращения (синдром Рейно, тромбофлебиты, тромбозы, иногда холодовая крапивница), возникающие в результате внутри- и внесосудистого гемолиза, приводящего к образованию внутрисосудистых конгломератов из агглютинированных эритроцитов и окклюзии сосудов микроциркуляторного русла.
Анемия обычно нормохромная или гиперхромная. В крови выявляют ретикулоцитоз, нормальное количество лейкоцитов и тромбоцитов, высокий титр холодовых агглютининов, обычно антител класса IgM и СЗ. Прямая проба Кумбса выявляет только СЗ. Нередко обнаруживают агглютинацию эритроцитов in vitro при комнатной температуре, исчезающую при подогревании.
Пароксизмальная холодовая гемоглобинурия
Заболевание в настоящее время редкое, бывает как идиопатическим, так и вызванным вирусными инфекциями (корью или эпидемическим паротитом у детей) или третичным сифилисом. В патогенезе основное значение имеет образование двухфазных гемолизинов Доната–Ландштейнера.
Клинические проявления развиваются после пребывания на холоде. Во время приступа возникают озноб и лихорадка, боли в спине, ногах и животе, головная боль и общее недомогание, гемоглобинемия и гемоглобинурия.
Диагноз ставят после обнаружения холодовых Ig-антител в двухфазной пробе на гемолиз. Прямая проба Кумбса либо отрицательная, либо выявляет СЗ на поверхности эритроцитов.
Главное в лечении аутоиммунных гемолитических анемий с холодовыми аутоантителами — предупреждение возможности переохлаждения. При хроническом течении заболевания используют преднизолон и иммунодепрессанты (азатиоприн, циклофосфамид). Спленэктомия обычно неэффективна.
Аутоиммунная лекарственная гемолитическая анемия
Лекарственные средства, вызывающие иммунную гемолитическую анемию, по патогенетическому механизму действия делятся на три группы.
К первой группе относятся препараты, вызывающие заболевание, клинические признаки которого аналогичны признакам аутоиммунной гемолитической анемии с тепловыми антителами. У большинства больных причиной заболевания является метилдофа.
При приеме этого препарата в дозе 2 г/сут у 20% больных отмечается положительная проба Кумбса. У 1% больных развивается гемолитическая анемия, в крови выявляют микросфероцитоз. На эритроцитах обнаруживают IgG.
Гемолиз ослабевает через несколько недель после прекращения приема метилдофы.
Ко второй группе относятся препараты, которые адсорбируются на поверхности эритроцитов, выполняют роль гаптенов и стимулируют образование антител к комплексу лекарственное средство — эритроцит.
Такими препаратами являются пенициллин и другие близкие по структуре антибиотики.
Гемолиз развивается при назначении препарата в высоких дозах (10 млн ед/сут и более), но обычно бывает умеренно выраженным и после отмены препарата быстро прекращается. Проба Кумбса при гемолизе бывает положительной.
В третью группу включены лекарственные препараты (хинидин, сульфаниламиды, производные сульфанилмочевины, феницитин и др.), вызывающие образование специфических антител комплекса IgM. Взаимодействие антител с лекарственными препаратами приводит к образованию иммунных комплексов, оседающих на поверхности эритроцитов.
Прямая проба Кумбса бывает положительной только по отношению к СЗ. Непрямая проба Кумбса положительная только в присутствии лекарственного препарата. Гемолиз чаще бывает внутрисосудистым и быстро проходит после отмены лекарственных средств.
Механическая гемолитическая анемия
Механические повреждения эритроцитов, приводящие к развитию гемолитической анемии, возникают:
- при прохождении эритроцитов по мелким сосудам над костными выступами, где подвергаются сдавлению извне (маршевая гемоглобинурия);
- при преодолении градиента давления на протезах клапанов сердца и сосудов;
- при прохождении по мелким сосудам с измененными стенками (микроангиопатическая гемолитическая анемия).
Маршевая гемоглобинурия возникает после длительной ходьбы или бега, занятий каратэ или тяжелой атлетикой и проявляется гемоглобинемией и гемоглобинурией.
Гемолитическая анемия у больных с протезированными клапанами сердца и сосудов обусловлена внутрисосудистыми разрушениями эритроцитов.
Гемолиз развивается примерно у 10% больных с протезированным аортальным клапаном (стеллитовые клапаны) или его дисфункцией (околоклапанная регургитация).
Биопротезы (свиные клапаны) и искусственные митральные клапаны редко вызывают значительный гемолиз. Механический гемолиз обнаруживают у больных с аортобедренными шунтами.
Гемоглобин снижается до 60–70 г/л, появляются ретикулоцитоз, шизоциты (обломки эритроцитов), снижается содержание гемоглобина, возникают гемоглобинемия и гемоглобинурия.
Лечение направлено на уменьшение дефицита железа, назначаемого внутрь, и ограничение физической нагрузки, что снижает интенсивность гемолиза.
Микроангиопатическая гемолитическая анемия
Является вариантом механического внутрисосудистого гемолиза. Заболевание возникает при тромботической тромбоцитопенической пурпуре и гемолитико-уремическом синдроме, синдроме диссеминированного внутрисосудистого свертывания, патологии сосудистой стенки (гипертонических кризах, васкулитах, эклампсии, диссеминированных злокачественных опухолях).
В патогенезе этой анемии основное значение имеет отложение нитей фибрина на стенках артериол, проходя через переплетения которых эритроциты разрушаются. В крови выявляются фрагментарные эритроциты (шизоциты и шлемовидные клетки) и тромбоцитопения. Анемия обычно резко выражена, уровень гемоглобина снижается до 40–60 г/л.
Проводят лечение основного заболевания, назначают глюкокортикоиды, свежезамороженную плазму, плазмаферез и гемодиализ.
Fii Sanatos
Гемолитические анемии — группа анемий, обусловленных повышенным разрушением эритроцитов. Следствием этого является снижение уровня гемоглобина, гипербилирубинемия или гемоглобинемия, реактивная гиперплазия эритроидного ростка костного мозга, ретикулоцитоз, спленомегалия, т.е.
те общие клинико-лабораторные признаки, которые и объединяют разные по своему патогенезу анемии в одну группу. Согласно современной классификации, гемолитические анемии принято делить на наследственные и приобретенные.
В свою очередь наследственные подразделяют на три основные группы по принципу локализации генетически детерминированного дефекта: мембранопатии, энзимопатии, гемоглобинопатии.
Приобретенные гемолитические анемии делят по принципу уточнения фактора, вызвавшего анемию: антитела, механическая травма, химическое повреждение, разрушение эритроцитов паразитами, дефицит витамина Е. Наиболее часто в практике врачей разных специальностей встречаются аутоиммунные гемолитические анемии (АИГА).
Под АИГА понимают такую форму иммунной гемолитической анемии, при которой антитела вырабатываются против собственного неизмененного антигена эритроцитов или эритроидных клеток костного мозга.
В первом случае имеет место гемолитическая анемия с антителами против антигенов эритроцитов периферической крови, во втором — АИГА с антителами против антигенов эритрокариоцитов.
К группе АИГА не относятся гаптеновые (гетероиммунные) формы, обусловленные появлением на мембране эритроцита гаптена, роль которого обычно выполняет вирус, лекарственное вещество или его фрагмент.
В этом случае антитела вырабатываются не против собственного антигена, а против гаптена (т.е. «чужого»). В зарубежной литературе эти анемии обычно относят к лекарственным им¬мунным гемолитическим анемиям. Тип гемолиза может быть различным (внесосудистым, внутрисосудистым).
Классификация
Все АИГА независимо от клеточной направленности антител подразделяют на идиопатические и симптоматические. Под симптоматическими формами понимают такие, при которых аутоиммунный гемолиз развивается на фоне других заболеваний и в связи с ними.
К заболеваниям, для которых наиболее характерны симптоматические АИГА, относятся системная красная волчанка, ревматоидный артрит, хронический активный гепатит, хронический лимфолейкоз, неходжкинские лимфомы, лимфогранулематоз.
АИГА рассматривается как идиопатическая, если возникает не как следствие или симптом какой-либо патологии, а как самостоя-тельное проявление заболевания. АИГА чаще встречаются у женщин, чем у мужчин.
Патогенез
Благодаря фундаментальным работам М. Бернета, Л. Феннера, П.
Медавара известно, что по отношению к собственным тканям в организме человека имеется естественная иммунологическая толерантность, возникающая в период внутриутробного развития.
При АИГА происходит срыв иммунологической толерантности, в связи с чем, собственные антигены эритроцитов распознаются как чужие и против них вырабатываются антитела.
Формы
Симптомы и лечение аутоиммунной гемолитической анемии
Гемолитическая анемия – это болезнь, которая характеризуется разрушением эритроцитов. При ней сокращается срок жизни эритроцитов. В норме они существуют около 120 дней.
Ежедневно около 1% красных клеток удаляется из крови. Количество погибших эритроцитов повышается на фоне гемолиза (разрушения). Из-за этого формируется гипоксия тканей головного мозга и внутренних органов.
Физиологически взамен погибших клеток из красного костного мозга в кровь выделяются молодые эритроциты и депо. Так происходит «омоложение» крови. При гемолитических состояниях (аутоиммунная, B12-дефицитная) – этот процесс нарушается.
Интенсивное разрушение красных клеток крови не уравновешивается образованием молодых форм. Расшифровка анализа крови в такой ситуации показывает ретикулоцитоз (повышенное количество несозревших эритроцитов).
Наличие ретикулоцитоза в лабораторных анализах подтверждает диагноз гемолитической анемии. Даже на фоне нормальной концентрации гемоглобина крови появление ретикулоцитов свидетельствует о наличии гемолиза.
Аутоиммунная гемолитическая анемия – что это
Чтобы ответить на вопрос, опишем патогенез заболевания.
Первым признаком недуга является апластический (арегенераторный) криз. При нем формируется недостаточность костного мозга. На фоне патологии возникает раздражение эритроидного красного ростка. Арегенераторная гемолитическая анемия (апластическая) сопровождается снижением количества ретикулоцитов, поэтому расшифровка анализа крови не показывает специфических изменений.
Если пропустить начальную стадию заболевания, возникает тяжелая анемия гемолитического типа. Пациенты знают, выраженный гемолиз – это такое состояние, при котором возникает сильная слабость, не позволяющая выполнять обычную физическую нагрузку. При кризах человек может потерять сознание.
Аутоиммунная гемолитическая анемия – это разрушение эритроцитов, возникающее из-за поражения эритроидного ряда антителами иммунной системы. Причина этого заболевания неизвестна. Клинические эксперименты показали значительное влияние на возникновение патологии наследственных факторов.
Гемолиз – что это такое
Гемолиз – это такое состояние, которое сочетается с компенсаторной гиперплазией эритроидного ростка. На его фоне формируется уменьшение количества ретикулоцитов крови. При длительном течении болезни возникает тяжелая и угрожающая форма патологии. Сокращение сроков жизни красных клеток крови на этом фоне приводит к опасным состояниям и серьезным осложнениям.
Гемолиз – это состояние, при котором не только нарушен процесс образования эритроцитов в костном мозге, но и возникает нарушение работы внутренних органов.
При выраженной гемолитической анемии нарушается работоспособность печени, селезенки и почек. Они «забиваются» разрушенными частями красных клеток крови. При гемолитической анемии на фоне гемолиза образуются особые патологические виды гемоглобина:
- Гаптоглобин;
- Гемопексин;
- Метгемоглобин.
Гаптоглобин образуется в печени и относится к классу альфа-глобулинов. Он имеет большую молекулу, которая не проникает через почечный фильтр.
Последняя анатомическая структура «забивается», поэтому нарушается работоспособность почек. Функциональная способность мочевыделительной системы на этом фоне снижается.
В результате поражаются почечные канальцы, что приводит к снижению экскреторной функции.
Комплекс гемоглобин-гаптоглобин накапливается в крови. При длительном существовании процесса резервы печени по синтезу гаптоглобина снижаются. Следствием состояние является накопление в крови токсических продуктов распада эритроцитов.
Продуктом катаболизма гема эритроцитов является билирубин. Он возникает на фоне разрушения этого белка в печени. За данный процесс отвечает фермент гемоксигеназа. Она содержится в селезенке, костном мозге, печени. Фермент приводит к разрушению альфа-метиленового мостика.
Химическим веществом, формирующимся при данном процессе, является вердогемоглобин. Это продукт промежуточной стадии метаболизма билирубина (желтого пигмента).
При его повышенном накоплении формируется не только токсическое поражение головного мозга, но и увеличивается риск образования камней желчного пузыря.
Следующим этапом процесса является образование биливердина с отщеплением железа. Фермент цитоплазматическая биливердин редуктаза приводит к превращению билирубина в биливердин. Определение этих веществ используется с целью изучения состояния гемолиза и выявления степени поражения печени.
Наблюдается накопление в сыворотке крови каждого из вышеописанных веществ. Билирубин и продукты его переработки в печени являются токсичными. Они приводят к гибели клеток головного мозга.
Токсические продукты в крови частично связываются белком гаптоглобин, что снижает их негативное влияние на организм. Резервные возможности печени по нейтрализации токсинов ограничены. При выраженной степени заболевания их будет недостаточно для предотвращения поражения головного мозга.
При гемолитических состояниях средней и большой степени выраженности белка гаптоглобина образуется мало, так как истощены резервы для его образования в печени. Интенсивный гемолиз приводит к разрушению красных кровяных клеток. Они выделяются с почками, поэтому у человека появляется моча цвета пива.
Виды гемолиза эритроцитов
В зависимости от вида выделяются следующие виды гемолиза:
- Внутрисосудистый;
- Внутриклеточный.
При первом типе разрушение осуществляется внутри сосудов. При втором – в ретикулоэндотелиальной системе (селезенка, печень, костный мозг). На этом наблюдается увеличение селезенки – спленомегалия. Увеличивается печень – гепатомегалия. Одновременно наблюдается желтушность кожных покровов и склер глаз за счет повышенных концентраций билирубина в крови.
На фоне резкого увеличения данного пигмента при гемолитической анемии кровь приобретает коричневый оттенок. В данной ситуации врачи опасаются развития двс-синдрома (диссеминированное внутрисосудистое свертывание), при котором существует риск тромбоза и кровоизлияния в сосудах всего организма.
Другие виды антител вызывающих анемии гемолитического вида:
- Гемолизины;
- Холодовые агглютинины;
- Доната-Ландштейнера;
- Эритроопсонины;
- Антитела против нормобластов.
Причины аутоиммунных гемолитических анемий
Причины заболевания неизвестны. При них наблюдается образование аутоантител к эритроцитам.
Патогенетическая классификация аутоиммунных гемолитических анемий:
- Аутоиммунные;
- Изоиммунные.
При аутоиммунных формах возникает нестабильность иммунитета, что приводит к образованию защитных белков, поражающих эритроидной ряд. Антитела вступает в связь с рецепторами эритроцитов, что приводит к разрушению этих клеток. Данные антитела относятся к классу иммуноглобулинов типа G. Реже – это иммуноглобулины A или M.
Изоиммунные гемолитические анемии формируются за счет несовместимости по резус-фактору между кровью плода и матери. Они наблюдаются у новорожденных и требуют незамедлительного переливания крови.
Аутоиммунные анемии по симптомам разделяются на гемолитические и идиопатические. Симптоматические виды возникают на фоне других болезней, приводящих к изменениям иммунитета. Такие формы встречаются на фоне лейкоза, ревматоидного артрита, лимфогранулематоза, гепатита.
Когда причину аутоиммунных гемолитических анемий нельзя связать с вторичной патологией считают, что она имеет идиопатический характер.
Появление аутоантител связывают с нарушением функциональности иммунокомпетентных клеток, которые воспринимают эритроцитарный росток чужеродным для организма.
На фоне воздействия иммунных комплексов на красные клетки крови возникает агглютинация (склеивание) и дальнейший распад эритроцитов.
В научных опытах выделены следующих антитела:
- Тепловые гемолизины;
- Неполные агглютинины;
- Холодовые агглютинины;
- Двухфазные агглютинины;
- Двухфазные гемолизины;
- Антитела против нормобластов.
Самым популярным видом считаются тепловые агглютинины (около 80%).
B12 дефицитная анемия сопровождается появлением в крови некоторых из вышеописанных видов антител. Они формируются на фоне внутрисосудистого разрушения красных клеток. Если процесс продолжается длительно, возникает сенсибилизация иммунитета к эритроидному ростку. К процессу подключаются не только звенья иммунной системы, но и Т-лимфоциты. Они уничтожают эритроциты путем фагоцитоза.
Очевидно, что при аутоиммунных гемолитических анемиях возникают серьезные изменения иммунной системы, которые невозможно остановить лекарственными препаратами. При патологии образуются иммуноглобулины G, которые свидетельствуют о том, что малокровие с гемолизом эритроидного ряда имеет хроническое течение.
Патогенез гемолитической аутоиммунной анемии
Патогенез гемолитической аутоиммунной анемии связан с постепенным разрушением мембраны клеток эритроидного ряда. Стареющие виды разрушаются фагоцитами крови, костного мозга, печени и селезенки. Разрушение сопровождается высвобождение билирубина, вердоглобина и других форм преобразования гема, о котором мы писали несколько выше.
Метаболизм билирубина связан с его выделением через почки. Из-за этого патогенетические особенности заболевания связаны с поражением печени, почек, костного мозга и селезенки. При расшифровке анализа крови при гемолитической анемии в моче обнаруживается повышенное количество уробилина, а в кале – избыток стеркобилина.
При видах патологии, связанных с аномалиями эритроцита, лабораторные анализы показывают увеличение фосфатов при дефекте фермента Эмбдена-Мейергофа, недостаток глюкозо-6-фосфатдегидрогеназы.
Гемолитическая анемия, возникающая при внешнем действии физических факторов, можно выявить холодовые антитела или маршевую гемоглобинурию (связана с разрушением эритроидного ростка во время ходьбы).
Что провоцирует гемолитический процесс (острый и хронический)
Острый гемолитический процесс провоцирует следующие состояния:
- Лекарства (сульфоны, свинец, фенилгидразин);
- Переливание крови при резус-конфликте;
- Ожоги;
- Искусственные клапаны сердца;
- Инфекции (клостридия, бартонелла).
В редких случаях встречается гемолиз при приеме антипиретиков, антималярийных лекарств, сульфаниламидов.
Когда возникает хронический гемолиз эритроцитов
Хронический гемолиз эритроцитов формируется на фоне следующих состояний:
- Идиопатическая ночная гемоглобинурия;
- Пароксизмальная холодовая гемолитическая анемия;
- Холодовая агглютинация;
- Маршевая гемоглобинурия.
Хронический гемолиз эритроцитов формируется постепенно, поэтому его симптомы на начальных стадиях не проявляются. Заболевание лучше обнаружить сразу, чтобы предотвратить серьезные осложнения.
При приеме лекарств человек сразу ощущает усиление симптомов болезни. Появляется усталость, недомогание. Если фармацевтический препарат отменить, состояние улучшается.
Симптомы на ранних и поздних стадиях
Симптомы гемолитической (аутоиммунной, апластической) анемии на ранних и поздних стадиях проявляются по-разному. При тяжелом течении недуг проходит три стадии:
- Гемолитический криз;
- Субкомпенсация;
- Компенсация.
Криз возникает в любом возрасте. Его провоцируют вторичные заболевания, введение вакцин и прием лекарств. Существуют случаи, возникающие без видимых причин. На фоне криза гемолитические реакции усиливаются.
Гемолитический криз протекает 2 стадии:
- Анемический синдром;
- Билирубиновая интоксикация.
При билирубиновой интоксикации возникает иктеричность (желтушность) кожных покровов, боли в животе, тошнота, головные боли и головокружения. У некоторых пациентов наблюдается лихорадка, судороги и расстройство сознания.
Анемический синдром характеризуется бледностью кожных покровов, глухостью сердечных тонов, появлением систолического шума на верхушке, слабостью и одышкой.
Во время криза возможны следующие осложнения:
- Сердечно-сосудистая недостаточность;
- Анемический шок;
- ДВС-синдром;
- Арегенераторный криз;
- Синдром «сгущения желчи» с образованием камней;
- Почечная недостаточность;
- Гепатоспленомегалия (увеличение печени и селезенки).
Внешние клинические симптомы гемолитической анемии:
- Пожелтение кожи;
- Субиктеричность склер;
- Дискинезия желчных путей;
- Патология селезенки;
- Гиперспленизм;
- Подкапсульные разрывы.
Таким образом, внешние симптомы гемолитической анемии типичны, но появляются они при средней и тяжелой степени болезни. Во время патологии возникает гемосидероз и дискинезия желчных путей.
Симптомы приобретенных и врожденных гемолитических анемий
Симптомы гемолитических приобретенных анемий возникают под влиянием провоцирующих факторов. При повышенной нагрузке на эритроидный росток усиливается внутрисосудистая агглютинация и гемолиз.
При малярии, дефиците витамина Е и пароксизмальной ночной форме возникают патогномоничные изменения, которые можно определить при расшифровке лабораторного анализа крови: ретикулоцитоз, уменьшение количества эритроцитов.
Каждая уникальная форма имеет свои специфические критерии диагностики. Правда, нужно понимать, что существует физиологический макроцитоз, фетальный гемоглобин у новорожденных и другие признаки заболевания.
Наследственные мембранопатии (дефекты мембраны эритроцитов)
Наследственные мембранопатии формируются на фоне дефектов мембраны эритроцитов. Они наследуются по аутосомно-рецессивному или доминантному типу. Разрушаются клетки эритроидного ряда преимущественно внутриклеточно в печени и селезенке.
Классификация мембранопатий:
- Дефект белка мембраны (микросфероцитоз, стоматоцитоз, эллиптоцитоз, пойкилоцитоз);
- Нарушение липидного спектра (акантоцитоз, недостаток лецитин-ацил-трансферазы);
- Другие дефекты мембраны (детский пикноцитоз).
Как определить гемолитическую аутоиммунную анемию
Чтобы определить гемолитическую аутоиммунную анемию, обязательно выполняются лабораторные анализы крови:
- Определение ретикулоцитов крови;
- Ультразвуковое исследование состояния печени и селезенки;
- Биохимический анализ крови на содержание ферментов АлАт, АсАт;
- Оценка концентраций уробилина мочи и стеркобелина кала;
- Повышение среднего содержания гемоглобина эритроцитов (MCH) в общем анализе крови из пальца;
- Бензидиновый тест на миоглобин и гемосидерин.
Какие формы эритроцитов характерны для аутоиммунных гемолитических анемий:
- Шистоциты;
- Сфероциты;
- Мишеневидные;
- Серповидные;
- Тельца Гейнца;
- Агглютинированные;
- Ядросодержащие;
- Акантоциты.
Определить гемолиз можно на основе ряда простых тестов, но решающим критерием болезни является определение срока жизни эритроцитов с помощью сцинтиграфических методов. Для определения иммуноглобулинов можно провести антиглобулиновый тест и пробу Кумбса. Изучить состояние эритроцитов помогает взятие мазка крови из пальца.
Другими тестами для изучения состояния крови является флоуцитометрия, электрофорез гемоглобина, исследование ферментов, тест на глюкозу, определение резистентности эритроидного ряда, изучение осмотической резистентности красного кроветворного ростка.
В заключение добавим, что осложняет течение недуга гемолитико-уремический синдром. Он возникает при аутоиммунных болезнях. Заболевание сочетается с тромбоцитопенией, поражением почек, диссеминированными изменениями в капиллярах и сосудах. На фоне патологии может развиться ДВС-синдром (диссеминированное внутрисосудистое свертывание).
Таким образом, гемолитическая анемия – это опасное заболевание, которое сочетается с изменениями во многих органах (печень, костный мозг и селезенка).
Лечение малокровия – лучшие способы
Лечение малокровия проводится противовоспалительными препаратами. Минимальные дозировки преднизолона (60-80 мг) назначаются при легкой степени заболевания. При средней и тяжелой стадии доза лекарства увеличивается до 150 мг.
Чтобы улучшить эффективность лечения лучше разделить дозировку на 3 приема. Стероидные противовоспалительные средства обладают побочными эффектами. Они угнетают деятельность гормонов коры надпочечников. Из-за этого лекарство вводится постепенно. Отменяется оно медленно.
Если резко отказаться от применения преднизолона, у человека может возникнуть кризис. Чтобы он не появился, в течение 5 дней пациенту назначается поддерживающая дозировка (2,5 мг).
При хроническом малокровии используется 20-25 мг преднизолона. По мере улучшения состояния пациента эритропоэз регулируется 5-10 мг препарата.
Удаление селезенки рекомендовано только тем пациентам, у которых противовоспалительное лечение не приводит к стойкой ремиссии болезни.
При выраженных состояниях вместе с преднизолоном применяются иммуномодуляторы (циклофосфамид, имуран, метотрексат). Глубокие кризы требуют переливания эритроцитарной массы.
Таким образом, диссеминированное разрушение эритроцитов – это опасная патология. Ее легко диагностировать, но сложно лечить.