Состав белков в организме очень обширен и разнообразен. На сегодняшний день ученым удалось определить и идентифицировать более ста единиц. Причем большая их часть выделена в чистом виде и хорошо изучена. Простые белки крови, в состав которых входят альбумины, глобулины и фибриноген представлены в большом объеме, тогда как сложные – в маленьком количестве.
Белковые соединений
В зависимости от аминокислотного состава и физико-химических параметров выделяют белковые фракции, которые обладают специфическими характеристиками.
Чтобы повысить точность разделения на фракции, эту операцию рекомендуется проводить в электрическом поле при электрофорезе. Данная методика основывается на перемещении белковых молекул при воздействии электрического импульса с разной скоростью.
Термины: Электрофорез – это явление перемещения частиц, содержащихся в белковых расворах (крови в данном случае) под влиянием внешнего электрического поля.
Таблица норм фракций белка
Альбумины – самая большая фракция, которая способна удерживать воду, и на ее долю приходится около 85 % коллоидно-осмотического давления плазмы крови.
Снижение уровня альбуминов называется гипоальбуминемией. Причины такого рода патологии связаны с нехваткой белка в организме, проблемами с его синтезом, в том числе если человек соблюдает безбелковую диету. При этом отмечается понижение онкотического давления, следствием чего становится сильная отечность. Гидрофильность альбуминов значительно снижается по причине наличия в крови психотропных, наркотических, отравляющих веществ и алкоголя.
Глобулины делятся на два вида: альфа-1-глобулины и альфа-2-глобулины. Повышенная концентрация альфа-глобулинов обязательно сопровождает воспалительный процесс в организме, в том числе стрессовые ситуации, ожоги, травмы.
Эти белковые компоненты позволяют определить, насколько интенсивно протекает воспалительное поражение организма. Они считаются белками острой фазы заболевания.
Когда увеличивается концентрация альфа-2-глобулинов, чаще всего это свидетельствует о протекании гнойного процесса.
Белки плазмы крови и их функции
Функции белков плазмы крови следующие:
В организме человека около трех литров крови. При этом одну шестую часть объема занимают белки. Этого хватает для реализации нормальной жизнедеятельности. Чаще всего клетки организма захватывают не столько белки, сколько аминокислоты (альбумины – их главный резерв).
Хотя есть единицы, которые способны выполнять захват плазменного белка и расщеплять его посредством специальных ферментов.
Далее высвободившееся количество аминокислот блуждает по кровотоку, где остальные клетки могут их использовать, чтобы в дальнейшем создавать новые белковые элементы.
Функции белка
Некоторые молекулы при транспортировке их по кишечнику к месту назначения налаживают взаимосвязь со специфическими плазменными белковыми соединениями (гормоны, липиды, жирные кислоты и др.).
- Обеспечение коллоидно-осмотического давления
В виду того, что молекулярный объем белков невелик, говорить об их существенной роли для онкотического давления не стоит. Но если учесть то, что именно белковые вещества создают коллоидно-осмотическое давление, выполняя важную задачу в перераспределении воды между плазмой и межклеточной жидкостью, ситуация меняется кардинально.
Капиллярные элементы легко пропускают некрупные молекулы, поэтому их количество и создаваемое ими давление идентично в плазме и в межклеточной жидкости. Габаритным молекулам нужно потратить больше усилий, чтобы проникнуть внутрь клетки.
Для альбумина это время составляет около пятнадцати часов. Более того, белковые соединения способны захватываться клетками и транспортироваться посредством лимфы крови.
В связи с чем плазма и межклеточная жидкость устанавливают некий градиент их количества, что обязательно обуславливается различием в коллоидно-осмотическом давлении.
И если концентрация белковых элементов, содержащихся в плазме, меняется, может произойти нарушение нормального обмена веществ в организме и перераспределение воды между кровью и межклеточной жидкостью.
Благодаря тому, что белки плазмы крови способны участвовать в различных процессах, вступая в связь с кислотами и щелочами, они играют важнейшую роль в поддержании нормального уровня pН.
- Предупреждение кровопотерь.
Белки обеспечивают работу свертывающей и противосвертывающей системы крови, рассасывание сгустков. Наша физиология установлена так, что свертываемость крови позволяет препятствовать кровотечению, частично обуславливаясь присутствием фибриногена.
При этом свертывание представлено некоторой цепной реакцией. А без определенных ферментов и целой фракции белков плазмы здесь не обойтись. В завершение этого процесса фибриноген превращается в фибрин, образовывая сгусток.
Он становится преградой для дальнейшего кровотечения.
- Защитная функция белкового компонента плазмы.
Благодаря иммуноглобулинам в плазме происходит нахождение и распознавание чужеродных антител, в том числе их дальнейшее уничтожение. Белковая фракция комплемента реализует удаление антигена. Фракция ингибиторов ферментов позволяет создать новые активные ферменты, воссоединяясь с ними. Примером тому становится защита тканей легкого при гидролизе.
Фракции белков
Белковые соединения крови, в зависимости от своего состава, подразделяются на простые и сложные. Примером первой фракции являются альбумины, а второй – липопротеины, металлопротеины и гликопротеины. Рассмотрим же основные из них:
- Альбумины – индивидуальные белки плазмы крови, синтез которых происходит в печени. Обновляются эти элементы стремительно. Буквально за двадцать четыре часа синтезируется и распадается около 15 грамм альбумина. Если рассматривать функциональное назначение данной фракции, то ее задачи различны. В первую очередь это поддержка онкотического давления, создание резерва аминокислот, транспортировка полезных веществ к месту назначения (органам и тканям), особенно тех, что не растворяются в воде.
Альбумины
- Альфа-1-глобулины – физиологические полезные белки плазмы крови, отличающиеся гидрофильностью и невысокой молекулярной массой. Как только происходит сбой в работе почек, они выводятся вместе с мочой, при этом не создавая какого-либо влияния на онкотическое давление. Белки плазмы крови из фракции глобулинов доставляют липиды в место назначения, помогают крови нормально свертываться, в том числе угнетают определенные ферменты, неблаготворно влияющие на организм;
Альфа – 1 – глобулины и их функциональное назначение
- Альфа-2-глобулины стоит отнести к разряду высокомолекулярных белков. Их синтез происходит в печени. Эта фракция включает регуляторные вещества: а-макроглобулины, без участия которых невозможно протекание любого инфекционного или воспалительного процесса; гаптоглобулины – соединяясь с молекулами глобулина не дают выводиться железу из организма; церулоплазмины – задерживают медь в тканях.
Альфа-2-глобулины и их задачи
- Бета-глобулины синтезируются в печени. При этом они участвуют в процессе свертываемости крови. Данная фракция включает липопротеины невысокой плотности; трансферрин, который позволяет доставить железо в место назначения; вещества системы комплемента, которые позволяют иммунной системе функционировать должным образом; бета-липоротеиды, траснпортирующие молекулы протеина.
- Гамма-глобулины синтезируются посредством В-лимфоцитов. Эти белки крови биохимия изучает крайне подробно. Ведь данная фракция содержит иммуноглобулины, а они защищают наш организм от инфекции и внешних опасностей.
Гамма-глобулины
Глобулины слабо растворяются в воде и составляют почти 50% от всей массы белков крови. Нарушения их соотношения сигнализируют о заболеваниях и патологических состояниях. При этом меняется и структура белков.
Подробнее об этом можно узнать в разделе медицины под названием патофизиология. Определить такие нарушения можно после проведения биохимического анализа крови.
Результаты такого рода исследования и динамическая их характеристика по совокупности позволят точно сказать, насколько долго протекает болезнь, и эффективно ли ее лечение.
Почему меняется соотношение белковых составов сыворотки крови?
Белки плазмы крови подробно изучает биохимия, но изменение их концентрации тоже касается биологических процессов. Именно об этом далее и пойдет речь.
Любые изменения в концентрации белковых элементов фракций в плазме свидетельствуют о том, что в организме произошел сбой. Могут проявляться признаки инфекционного и вирусного процесса. Синтез большого количества а-1-глобулинов – это сигнал того, что в организме протекает воспаление, есть опухолевые образования, произошло хирургическое вмешательство или нарушена функция печени. Однако женщины в положении на третьем триместре могут показать такие же результаты анализа.
С увеличением объема соединений альфа-2-глобулинов связаны ожоги, воспаления, диффузные изменения соединительной ткани.
Если увеличилось число гамма-глобулинов, значит, произошел хронический сбой в функционировании печени, любого рода инфицирование, развился ревматизм или же красная волчанка. Высокая концентрация фракции бета-глобулинов говорит о гиперлипопротеинемии, нехватке железа, желтухе или нефротическом синдроме. Возможная – физиологическая причина беременность.
Важно! Кроме патологий, вызывать изменение соотношения белковых компонентов фракций могут и лекарственные средства.
Белки плазмы участвуют в разнообразных жизненно важных процессах в организме человека. С помощью этих небольших элементов в клетки, органы и ткани поступает необходимое количество питательных веществ, обеспечивается нормальная свертываемость крови. Концентрация определенных фракций изменяется под влиянием инфекций и в результате нарушения работы внутренних органов. Чтобы определить соотношение белков, обязательно проводится биохимический анализ крови крови.
Характеристика белков плазмы крови для новорожденных
При рождении у ребенка концентрация белковых соединений в сыворотке крови существенно ниже, если сравнивать с параметрами взрослого человека. К окончанию первого месяца от рождения это значение падает до минимальной отметки, а еще через два месяца нормализуется до объема взрослого человека.
В течение первых недель жизни у новорожденного количество глобулинов низкое. Тогда как после месяца и до одного года концентрация таких белков может даже превышать показания взрослого.
Что касается фибриногена, то к окончанию первого месяца после рождения параметры данного белка нормализуются.
Повышение и понижение общего объема белка
Общий объем белка в плазме может повышаться (гиперпротеинемия) или понижаться (гипопротеинемия).
Главные причины нехватки белка:
- недостаточное поступление белков и аминокислот в организм;
- высокие потери белка (распад);
- проблемы с синтезом белков в печени и органах. отвечающих за иммунитет.
Дефицит поступления белка в организм возникает как следствие голодания на протяжении длительного времени, безбелкового диетического питания, нарушения нормального функционировании желудочно-кишечного тракта. Организм может потерять большое количество белка после сильных кровотечений, острых и хронических, вследствие развития злокачественных опухолей.
Как повысить белок в крови
Ярко выраженная гипопротеинемия обязательно присутствует при патологических изменениях в почках и связывается с выводом из них большого количества белковых соединений.
Нарушения синтеза белка встречаются при недостаточности функции печени (цирроз).
Резкое превышение количества белка в плазме развивается после обезвоживания, когда организм теряет существенный объем внутрисосудистой жидкости. К примеру, такое состояние развивается после сильного перегревания тела, ожогов тяжелой степени, кишечных заболеваний (холера, дизентерия).
Вывод
Белки играют важную роль в организме человека, без их участия во множестве процессов ни один орган не смог бы работать. Поскольку белковых веществ существует огромное количество, их выделяют во фракции по функциям и физико-химическому составу.
На долю каждой фракции возлагаются определенные задачи, и любое отклонение от количественной нормы таких элементов свидетельствует о развитии патологий. Главное – вовремя проходить медицинское обследование и при недомогании обратиться к врачу.
Только своевременное выявление отклонений позволит успешно вылечить заболевание.
Белки плазмы крови
БЕЛКИ ПЛАЗМЫ КРОВИ
В плазме крови открыто более 200 видов белков, которые составляют 7% объема плазмы. Белки плазмы крови синтезируются в основном в печени и макрофагах, а также в эндотелии сосудов, в кишечнике, лимфоцитах, почках, эндокринных железах. Разрушаются белки плазмы крови печенью, почками, мышцами и др. органами. Т½ белков плазмы крови составляет от нескольких часов до несколько недель.
В плазме крови белки выполняют следующие функции:
- Создают онкотическое давление. Оно необходимо для удержания воды в кровяном русле.
- Участвуют в свертывании крови.
- Образуют буферную систему (белковый буфер).
- Транспортируют в крови плохорастворимые в воде вещества (липиды, металлы 2 и более валентности).
- Участвуют в иммунных процессах.
- Образуют резерв аминокислот, который используется, например, при белковом голодании.
- катализируют некоторые реакции (белки-ферменты).
- Определяют вязкость крови, влияют на гемодинамику.
- Участвуют в реакциях воспаления.
- Строение белков плазмы крови
- По строению белки плазмы крови являются глобулярными, по составу они делятся на простые (альбумины) и сложные.
- Среди сложных, можно выделить липопротеины (ЛПОНП, ЛППП, ЛПНП, ЛПВП, ХМ), гликопротеины (почти все белки плазмы) и металлопротеины (трансферин, церрулоплазмин).
Общее количество белка в плазме крови в норме составляет 70-90 (60-80) г/л, его определяют с помощью биуретовой реакции. Количество общего белка в крови имеет диагностическое значение.
Повышение общего количества белка в плазме крови называется гиперпротеинемия, снижение – гипопротеинемия. Гиперпротеинемия возникает при дегидратации (относительная), травмах, ожогах, миеломной болезни (абсолютная). Гипопротеинемия наступает при спаде отеков (относительная), голодании, патологии печени, почек, кровопотере (абсолютная).
Кроме общего содержания белков в плазме крови также определяют содержание отдельных групп белков или даже индивидуальных белков. Для этого их разделяют с помощью электроэлектрофореза.
Электрофорез – это метод, при котором вещества с различным зарядом и массой, разделяются в постоянном электрическом поле. Электрофорез проводят на различных носителях, при этом получают разное количество фракций.
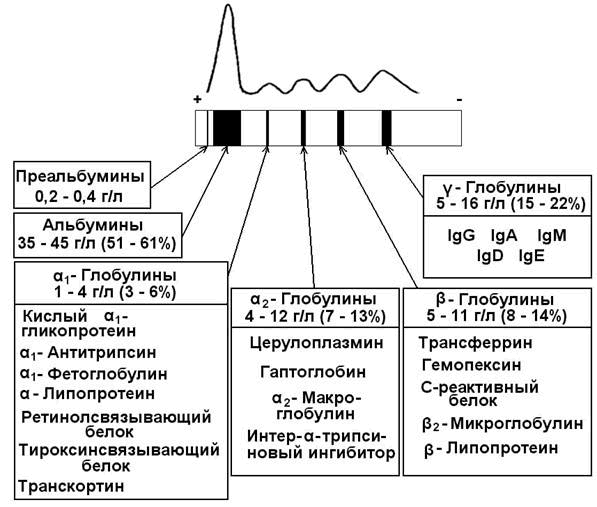
При электрофорезе на бумаге белки плазмы крови дают 5 фракций: альбумины, α1-глобулины, α2-глобулины, β-глобулины и γ-глобулины. При электрофорезе на агаровом геле получается 7-8 фракций, на крахмальном геле – 16-17 фракций.
Больше всего фракций – более 30, дает иммуноэлектрофорез.
Белки плазмы можно также разделить с помощью высаливания нейтральными солями щелочных и щелочноземельных металлов (3 фракции: альбумины, глобулины и фибриноген) или осаждения в спиртовом растворе.
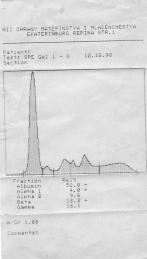
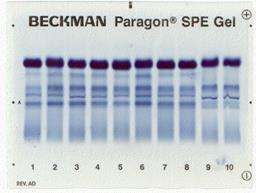
| Денситограмма белков сыворотки крови | Электрофореграмма белков сыворотки крови (10 пациентов) |
Целесообразность разделения белков на фракции связана с тем, что белковые фракции плазмы крови отличаются между собой преобладанием в них белков, с определенными функциями, местом синтеза или разрушения.
Нарушение соотношения белковых фракций плазмы крови называется диспротеинемия. Выявление диспротеинемии имеет диагностическое значение.
- Фракции белков плазмы крови
- I. Альбумины
- Основным белком этой фракции является альбумин.
Альбумин. Простой белок из 585 АК с массой 69кДа, имеет 17 дисульфидных мостиков, много дикарбоновых АК, обладает высокой гидрофобностью. У альбумина наблюдается полиморфизм. Синтезируется в печени (12 г/сут), утилизируется почками, энтероцитами и др. тканями. Т½=20 дней.
60% альбуминов находиться в межклеточном веществе, 40% — в кровяном русле. В плазме альбуминов 40-50г/л, они составляют 60% всех белков плазмы крови.
Функции: поддержание онкотического давления (вклад 80%), транспорт свободных жирных кислот, билирубина, жёлчных кислот, стероидных и тиреоидных гормонов, ХС, лекарств, неорганических ионов (Cu2+, Ca2+, Zn2+), является источником аминокислот.
Транстиретин (преальбумин). Тетрамер. В плазме 0,25г/л. Белок острой фазы (5 группа). Транспортирует тиреоидные гормоны и ретинолсвязывающий белок. Снижается при голодании.
Диспротеинемия альбуминовой фракции реализуется преимущественно за счет гипоальбуминемии.
Причиной гипоальбуминемии является снижение синтеза альбуминов при печеночной недостаточности (цирроз), при повышении проницаемости капилляров, при активации катаболизма вследствие ожогов, сепсисе, опухолях, при потере альбуминов с мочой (нефротический синдром), при голодании.
Гипоальбуминемия вызывает отек тканей, снижение почечного кровотока, активацию РААС, задержку воды в организме и усиление отека тканей. Резкий отток жидкости в ткани приводит к снижению АД и может вызвать шок.
Глобулины. Онисодержат липопротеины и гликопротеины.
II. α1-Глобулины
α1-Антитрипсин — гликопротеин, синтезируемый печенью. В плазме 2,5г/л. Белок острой фазы (2 группа). Важный ингибитор протеаз, в том числе эластаз нейтрофилов, которые разрушают эластин альвеол лёгких и печени. α1-Антитрипсин также ингибирует коллагеназу кожи, химотрипсин, протеазы грибков и лейкоцитов. При дефиците α1-антитрипсина могут возникнуть эмфизема лёгких и гепатит, приводящий к циррозу печени.
Кислый α1- гликопротеин, синтезируется печенью. В плазме 1 г/л. Белок острой фазы (2 группа). Транспортирует прогестерон и сопутствующие гормоны.
ЛПВП синтезируются в печени. В плазме 0,35 г/л. Транспортируют излишки ХС из тканей в печень, обеспечивают обмен других ЛП.
Протромбин — гликопротеид, содержащий около 12% углеводов; белковая часть молекулы представлена одной полипептидной цепью; молекулярная масса около 70000Да. В плазме 0,1 г/л.
Протромбин — предшественник фермента тромбина, стимулирующего формирование тромба. Биосинтез протекает в печени и регулируется витамином К, образуемым кишечной флорой.
При его недостатке витамина К уровень протромбина в крови падает, что может приводить к кровоточивости (ранняя детская геморрагия, обтурационная желтуха, некоторые болезни печени).
Транскортин — гликопротеин, синтезируемый в печени, масса 55700Да, Т½=5 суток. Переносит кортизол, кортикостерон, прогестерон, 17-альфа-гидроксипрогестерон и, в меньшей степени, тестостерон. В плазме 0,03 г/л. Концентрация в крови чувствительна к экзогенным эстрогенам и зависит от их дозы.
Тироксинсвязывающий глобулин (TBG) -синтезируется в печени. Молекулярная масса 57 кДа. В плазме 0,02 г/л. Т½=5 суток. Он является главным транспортером тироидных гормонов в крови (транспортирует 75% тироксина и 85% трийодтиронина).
Диспротеинемия за счет α1-глобулиной фракции реализуется преимущественно за счет: 1). снижения синтеза α1-антитрипсина. 2). Потере белков этой фракции с мочой при нефротическом синдроме. 3). повышения белков острой фазы в период воспаления.
III. α2-Глобулины
α2-Макроглобулин очень крупный белок (725 кДа), синтезируется в печени. Белок острой фазы (4 группа). В плазме 2,6 г/л. Главный ингибитор множество классов протеиназ плазмы, регулирует свертывание крови, фибринолиз, кининогенез, иммунные реакции. Уровень α2-макроглобулина в плазме уменьшается в острой фазе панкреатита и карциномы простаты, увеличивается — в результате гормонального эффекта (эстрогены).
Гаптоглобин – гликопротеид, синтезируется в печени. В плазме 1 г/л. Белок острой фазы (2 группа). Связывает гемоглобин с образованием комплекса, обладающего пероксидазной активностью, препятствует потери железа из организма. Гаптоглобин эффективно ингибирует катепсины С, В и L, может участвовать в утилизации некоторых патогенных бактерий.
Витамин Д связывающий белок (БСВ) (масса 70кДа). В плазме 0,4 г/л. Обеспечивает транспорта витамина А в плазме и предотвращает его экскрецию с мочой.
Церулоплазмин — главный медьсодержащий белок плазмы (содержит 95% меди в плазмы) с массой 150кДа, синтезируется в печени. В плазме 0,35 г/л. Т½=6 суток. Церулоплазмин обладает выраженной оксидазной активностью; ограничивает освобождение железа, активирует окисление аскорбиновой кислоты, норадреналина, серотонина и сульфгидрильных соединений, инактивирует активные формы кислорода, предотвращая ПОЛ.
Церулоплазмин — белок острой фазы (3 группа). Он повышается у больных с инфекционными заболеваниями, циррозом печени, гепатитами, инфарктом миокарда, системными заболеваниями, лимфогранулематозом, при злокачественных новообразованиях различной локализации (рак легкого, молочной железы, шейки матки, желудочно-кишечного тракта).
Болезнь Вильсона – Коновалова. Недостаточность церулоплазмина возникает при нарушении его синтеза в печени. При дефиците церулоплазмина Cu2+ уходит из крови, выводятся с мочой или накапливается в тканях (например, в ЦНС, роговице).
АнтитромбинIII. В плазме 0,3 г/л. Ингибитор плазменных протеаз.
Ретинолсвязывающий белок синтезируется в печени. В плазме 0,04 г/л. Связывает ретинол, обеспечивает его транспорт и предотвращает распад. Функционирует в комплексе с транстиретином. Ретинол связывающий белок фиксирует излишки витамина А, что предотвращает мембранолитическое действие высоких доз витамина.
Диспротеинемия за счет α2-глобулиной фракции может возникать при воспалении, т.к. в этой фракции содержатся белки острой фазы.
IV. β-Глобулины
ЛПОНП — образуются в печени. Транспорт ТГ, ХС.
ЛППП — образуются в крови из ЛПОНП. Транспорт ТГ, ХС.
ЛПНП – образуются в крови из ЛППП. В плазме 3,5 г/л. Транспортируют излишки ХС из периферических органов в печень.
Трансферрин – гликопротеин, синтезируется печенью. В плазме 3 г/л. Т½=8 суток. Главный транспортер железа в плазме, 1 молекула трансферрина связывает 2 Fe3+, а 1г трансферрина соответственно около 1,25 мг железа. При снижении концентрации железа синтез трансферрина возрастает. Белок острой фазы (5 группа). Снижается при печеночной недостаточности.
Фибриноген гликопротеин, синтезируется в печени. Молекулярная масса 340кДа. В плазме 3 г/л. Т½=100часов. Фактор I свёртывания крови, способен под действием тромбина превращаться в фибрин. Является источником фибринопептидов, обладающих противовоспалительной активностью.
Белок острой фазы (2 группа). Содержание фибриногена увеличивается при воспалительных процессах и некрозе тканей. Снижается при ДВС синдроме, печеночной недостаточности.
Фибриноген основной белок плазмы, влияющий на величину СОЭ (с повышением концентрации фибриногена скорость оседания эритроцитов увеличивается).
С-реактивный белок синтезируется преимущественно в гепатоцитах, его синтез инициируется антигенами, иммунными комплексами, бактериями, грибами, при травме (через 4-6 ч после повреждения). Может синтезироваться эндотелиоцитами артерий. В плазме
Функции белка плазмы крови
Благодаря крови осуществляется поступление важных веществ к внутренним органам и тканям. Ее доля в человеческом организме занимает второе место после мышечной ткани. Кровь в свою очередь состоит из жидкой среды – плазмы и находящихся в ней форменных веществ. В состав плазмы входят органические (небелковые и белковые) и минеральные соединения. Белки занимают около 7% объема плазмы крови и выполняют несколько важных функций для организма.
Значение белка
Общий белок – это показатель обменного процесса аминокислот в организме, характеризующий уровень концентрации белковых молекул и фракций в плазме. Значение показателя белкового метаболизма отражает способность организма к восстановлению. В состав плазмы крови входит более 100 видов белков. Синтез в большей степени осуществляется клетками печени (гепатоцитами). Важность белков обусловлена выполнением следующих функций:
- обеспечивают онкотическое давление, за счет которого вода удерживается в русле крови.
- Принимают участие в свертываемости крови.
- Поддерживают кислотно-щелочной баланс крови, так как создают белковый буфер.
- Обеспечивают транспортную функцию. Образуют соединение с некоторыми веществами (холестерин, билирубин и другие), составляющими медикаментозных препаратов и доставляют их к органам и тканям.
- Выполняют иммунную функцию организма.
- Создают резервный запас аминокислот.
- Обеспечивают определенную вязкость и текучесть крови.
- Принимают участие в реакциях организма на воспалительные процессы.
Уровень белка в крови определяют при биохимическом анализе крови, которое имеет важное диагностическое значение при многих патологических нарушениях. Одного лишь определения уровня белка недостаточно для того, чтобы точно поставить диагноз, поэтому при отклонении содержания от нормы производят биохимический анализ фракций белка и прочие дополнительные обследования. Также немаловажным при диагностике является исследование небелковых компонентов крови.
Фракции белков и их функции
Белки плазмы крови по своему составу делятся на простые и сложные. К простым относятся альбумины, а к сложным липопротеины, гликопротеины (подавляющее число белков плазмы) и металлопротеины (трансферин, церрулоплазмин). Белки плазмы крови представляют собой комплекс белков различных структур и функций. Выделение фракций из белков осуществляют с применением электрического тока — электрофорезом.
Разделить белки данным способом можно на большое количество фракций, но основными из них являются:
- альбумины — основная составляющая белков плазмы, синтезируемый клетками печени. Обновляется альбумин очень стремительно. За одни сутки происходит синтез и распад 10-16 грамм белков данной фракции. Альбумин осуществляет несколько функций для организма. Поддерживает онкотическое давление, создает резервный запас аминокислот, переносит вещества к органам и тканям, в особенности нерастворимые в воде.
- а1-глобулины. Фракция включает в себя нерастворимые белки с высокой гидрофильностью и низкой молекулярной массой. При нарушении функционирования почек быстро выводятся из организма вместе с мочой, не оказывая при этом значительного влияния на онкотическое давление. Выполняют транспортировку липидов, активно участвуют в свертываемости крови, угнетают некоторые ферменты, оказывающие негативное воздействие на организм.
- а2-глобулины, синтезируемые в печени в объеме 75%, являются высокомолекулярными белками. В состав фракции входят регуляторные белки: а2-макроглобулин — участвует в инфекционных и воспалительных реакциях; гаптоглобин — создает специфическое соединение с гемоглобином, препятствует выведению железа; церулоплазмин — обеспечивает постоянное содержание меди в тканях.
- b-глобулины, 50% синтеза осуществляется клетками печени. В фракцию b-глобулинов входят некоторые белки, обеспечивающие свертываемость крови. Большую часть состава фракции занимают: липопротеины низкой плотности; трансферрин — транспортирует железо; составляющие комплемента участвуют в реакции иммунной системы; бета-липопротеиды — переносят холестерин и фосфолипиды.
- g-глобулины, синтез осуществляется В-лимфоцитами. В состав фракции входят белки-антитела (иммуноглобулины) и некоторые элементы системы комплемента. Иммуноглобулины выполняют защитную функцию организма от инфицирования и внешних возбудителей.
Глобулины являются нерастворимыми компонентами плазмы и растворяются в слабоконцентрированных солевых растворах. Нарушение соотношения фракций белков определяется при многих патологических реакциях путем проведения биохимии крови. При анализе показателей в динамике и в совокупности с изменением небелковых соединений можно с высокой точностью определить длительность заболевания и эффективность проводимой терапии.
Причины изменения белковых фракций
Отклонение значений каждой из фракций свидетельствует о наличии нарушений в организме, вызванных реакцией на воспалительные процессы или инфицирование.
Например, повышение а1-глобулинов происходит в результате реакции организма на воспалительные процессы в хронической стадии, травмы и операции, опухолевые поражения, нарушении функционирования печени, третий триместр беременности.
Рост значения компонентов а2-глобулинов происходит при воспалительных процессах, ожоговых поражениях, нефротическом синдроме, диффузных патологиях соединительной ткани.
Повышенное значение компонентов фракции b-глобулинов происходит при гиперлипопротеинемии, миеломной болезни (вызвана синтезом патологических белков), дефиците железа, беременности, желтухе, нефротическом синдроме. Причинами роста g-глобулинов могут быть: хронические нарушения в работе печени, инфицирование, ревматизм, красная волчанка.
Кроме патологических процессов, повышение значений могут вызвать компоненты некоторых лекарственных препаратов.
Снижение альбуминов происходит при: нарушении питания, патологиях печени (снижается синтез альбуминов), опухолевых поражениях, коллагенозах, ожогах, гипергидрации, обильных кровотечениях, беременности, воспалительных процессах в тяжелой стадии течения. Снижение синтеза глобулинов происходит при иммунодефиците, беременности, панкреатите, дефиците иммуноглобулина IgA, реакции на терапию глюкокортикоидами, саркоидозе.
Белки плазмы крови выполняют важные для организма человека функции. Благодаря им осуществляется поступление важных веществ к клеткам и органам, обеспечивается свертываемость крови и другие. Колебание их уровня происходит в результате реакции организма на воздействие возбудителей, инфекций, воспалительные нарушения. Исследование общего белка и его фракций проводят при биохимическом анализе крови, имеющем важное значение при диагностике многих заболеваний.
В крови пять основных фракций белков
Плазма крови человека в норме содержит более 100 видов белков. Примерно 90% всего белка крови составляют альбумины, иммуноглобулины, липопротеины, фибриноген, трансферрин; другие белки присутствуют в плазме в небольших количествах.
Синтез белков плазмы крови осуществляют:
- печень – полностью синтезирует фибриноген и альбумины крови, большую часть α- и β-глобулинов,
- клетки ретикулоэндотелиальной системы (РЭС) костного мозга и лимфатических узлов – часть β-глобулинов и γ-глобулины (иммуноглобулины).
Существует довольно много различных методов разделения белков в зависимости от их некоторых качеств. Наиболее распространенным методом фракционирования белков крови является электрофорез..
Электрофорез белков
Ацетатцеллюлозная пленка, гель, специальная бумага (носитель) помещается на рамку, при этом противоположные края носителя свисают в кюветы с буферным раствором. На линию старта наносится сыворотка крови.
Метод заключается в движении заряженых молекул белка по поверхности носителя под влиянием электрического поля. Молекулы с наибольшим отрицательным зарядом и наименьшим размером, т.е. альбумины, двигаются быстрее остальных.
Наиболее крупные и нейтральные (γ-глобулины) оказываются последними.
На ход электрофореза влияет подвижность разделяемых веществ, находящаяся в зависимости от ряда факторов: заряд белков, величина электрического поля, состав растворителя (буферной смеси), тип носителя (бумага, пленка, гель).
Общий вид электрофореза
Количество выделяемых фракций определяется условиями проведения электрофореза.
При электрофорезе на бумаге и пленках ацетата целлюлозы в клинико-диагностических лабораториях выделяют 5 фракций (альбумины, α1-, α2-, β- и γ-глобулины), в то время как в полиакриламидном геле – до 20 и более фракций.
При использовании более совершенных методов (радиальная иммунодиффузия, иммуноэлектрофорез и других) в составе глобулиновых фракций выявляются многочисленные индивидуальные белки.
Электрофореграмма (вверху) и графический результат ее обработки (внизу)
На вид протеинограммы оказывают влияние только те белки, концентрация которых достаточно высока.
Нормальные величины белковых фракций плазмы крови
| Общий белок | взрослые | 65-85 г/л |
| дети 1-3 года | 55-85 г/л | |
| Белковые фракции | ||
| Альбумины | 50-70 % | 30-50 г/л |
| α1-Глобулины | 3-6 % | 1-3 г/л |
| α2-Глобулины | 9-15 % | 6-10 г/л |
| β-Глобулины | 8-18 % | 7-11 г/л |
| γ-Глобулины | 15-25 % | 8-16 г/л |
Нормальные величины фракций белков в ликворе и моче можно посмотреть здесь.
Особенности содержания белков в крови у детей
У новорожденных содержание общего белка в сыворотке крови значительно ниже, чем у взрослых, и становится минимальным к концу первого месяца жизни (до 48 г/л). Ко второму-третьему годам жизни общий белок повышается до уровня взрослых.
В течение первых месяцев жизни концентрация глобулиновых фракций низка, что приводит к относительной гиперальбуминемии до 66-76%. В периоде между 2-м и 12-м месяцами концентрация α2-глобулинов временно превышает взрослый уровень.
Количество фибриногена при рождении гораздо ниже, чем у взрослых (около 2,0 г/л), но к концу первого месяца достигает обычной нормы (4,0 г/л).
Типы протеинограмм
В клинической практике для сыворотки выделяют 10 типов электрофореграмм (протеинограмм), соответствующих различным патологическим состояниям.
| α1 | α2 | β | γ | |||
| Острые воспаления | ↓↓ | ↑ | ↑ | — | ↑ | Начальные стадии пневмоний, острые полиартриты, экссудативный туберкулез легких, острые инфекционные заболевания, сепсис, инфаркт миокарда |
| Хронические воспаления | ↓ | — | ↑↑ | — | ↑↑ | Поздние стадии пневмоний, хронический туберкулез легких, хронический эндокардит, холецистит, цистит и пиелит |
| Нарушения почечного фильтра | ↓↓ | — | ↑ | ↑ | ↓ | Генуинный, липоидный или амилоидный нефроз, нефрит, нефросклероз, токсикоз беременности, терминальные стадии туберкулеза легких, кахексии |
| Злокачественные опухоли | ↓↓ | ↑↑ | ↑↑ | ↑↑↑ | ↑↑ | Метастатические новообразования с различной локализацией первичной опухоли |
| Гепатиты | ↓ | — | — | ↑ | ↑↑ | Последствия токсического повреждения печени, гепатиты, гемолитические процессы, лейкемии, злокачественные новообразования кроветворного и лимфатического аппарата, некоторые формы полиартрита, дерматозы |
| Некроз печени | ↓↓ | — | ↓ | ↑ | ↑↑ | Цирроз печени, тяжелые формы индуративного туберкулеза легких, некоторые формы хронического полиартрита и коллагенозов |
| Механические желтухи | ↓ | — | ↑ | ↑ | ↑ | Обтурационная желтуха, желтухи, вызванные развитием рака желчевыводящих путей и головки поджелудочной железы |
| α2-глобулиновые плазмоцитомы | ↓ | ↓ | ↑↑ | ↓ | ↓ | α2-Плазмоцитомы |
| β-глобулиновые плазмоцитомы | ↓ | ↓ | ↓ | ↑↑ | ↓ | β1-Плазмоцитомы, β1-плазмоклеточная лейкемия и макроглобулинемия Вальденштрема |
| γ-глобулиновые плазмоцитомы | ↓ | ↓ | ↓ | ↓ | ↑↑ | γ-Плазмоцитомы, макроглобулинемия и некоторые ретикулезы |
Альбумины и глобулины, как представители белков плазмы
Кровь человека состоит из форменных элементов, например, лейкоциты, тромбоциты, эритроциты, и жидкой части. Процентное содержание форменных элементов равно 45 %, а плазма крови занимает 55%.
- Под плазмой крови необходимо понимать сложную биологическую среду, в ней содержится 7% белка, 92% воды, 1% углеводов, жиров и минеральных солей.
- В данной статье мы более подробно рассмотрим белки плазмы.
- Белками плазмы называют сложные высокомолекулярные азотсодержащие биологические соединения, которые состоят из 20 стандартных аминокислот.
Структура белков
Все белки разделяются на простые и сложные. Если говорить о простых, то они состоят из аминокислот:
- Гистон;
- Протамин;
- Альбумин;
- Глобулин.
В состав сложных белков помимо аминокислот входят и дополнительные соединения:
- Фосфоропротеиды;
- Нуклепротеиды;
- Хромопротеиды;
- Глюкопротеиды;
- Липопротеиды.
Белки плазмы занимают особое место особое место в процессе свертываемости крови, защищают организм от попадания инородных белков, поддерживают гомеостаз.
Это важно! Белки плазмы принято различать по функциональным свойствам и строению. Определение их количественного и качественного строения производят с помощью специальных методов электрофореза, который основан на разной подвижности белка в электрическом поле (ультрацентрифугирование, иммуноэлектрофорез).
По подвижности при электрофорезе принято различать пять фракций белков, их можно условно подразделить на альбумины, α1, α2, β, и γ-глобулины.
Информация о альбуминах и глобулинах
Белки плазмы можно разделить несколько групп: альбумины и глобулины. К глобулиновой фракции относится фибриноген. В норме в плазме содержится: глобулины- 20−30 г/л, альбумины- 40−50 г/л, фибриноген- 2,4 г/л. Плазму крови, лишенную фибриногена, называют сывороткой.
В плазме общее количество белка колеблется в пределах 65−85 г/л, в сыворотке меньше на 2−4 г/л, по сравнению с плазмой из-за отсутствия фибриногена.
Повышение и понижение содержания белков в плазме крови
Если говорить о общем количестве белка, то оно бывает пониженное (гипопротеинемия) или повышенное (гиперпротеинемия).
Понижение количества белка (гипопротеинемия) может быть следствием:
- нарушения его выработки (результат печеночной недостаточности на фоне гепатита, цирроза или дистрофии печени);
- недостатка белка (длительное голодание, диета, нарушение работы ЖКТ);
- его повышенной потери (результат острых и хронических кровотечений, злокачественных новообразований).
Гиперпротеинемия является следствием обезвоживания — результат перегрева организма, обширных ожогов, тяжелых травма, холеры, миеломной болезни.
Образование и функции
Если говорить о белках плазмы, то они выполняют целое множество функций:
- Одной из главных является поддержание осмотического давления (благодаря тому, что белки способны связывать воду и удерживать её в кровеносном русле).
- Альбумины (транскортинтранстиретин, трансферрин) — выполняют важнейшую транспортную функцию.
- Белки являются основным резервом аминокислот для человеческого организма;
- Они также отвечают и за вязкость крови.
Синтез
Главное место образования белков плазмы считается печень. В ней синтезируются альбумины и фибриноген. Если говорить о синтезе глобулинов, то они вырабатываются не только в печени, но и в лимфатических узлах, селезенке, костном мозгу, то есть в органах, которые относятся к ретикуло-эндотелиальной системе.
Это важно! Если человек здоров, то концентрация белков плазмы сохраняется на постоянном уровне. Но существует ряд случаев, когда их концентрация изменяется, это является результатом поражений органов, который принимают непосредственное участие в синтезе и катаболизме данных белков.
Общие функции белков плазмы крови
Плазма крови
— это соломенного цвета, жидкий компонент крови, который вместе с ресуспендироваными клетками образуют цельную кровь. Плазма составляет около 55% общего объема крови. Это внутрисосудистая часть общего объема внеклеточной жидкости (всей жидкости организма вне клеток).
Основная часть плазмы представлена водой – 93% и содержит растворенные белки, глюкозу, факторы свертывания крови, ионы минералов, гормоны и углекислый газ; через плазму осуществляется транспорт всех экскретируемых продуктов (шлаков). Белки плазмы служат резервом белков организма человека. Плазма играет важную роль во внутри сосудистом осмотическом эффекте, который обеспечивает электролитный баланс; плазма защищает организм от инфекций и других заболеваний.
Получают плазму крови путем осаждения клеток — центрифугированием цельной крови, к которой добавлен антикоагулянт (вещество препятствующее свертыванию крови); плазму отсасывают или сливают. Плотность плазмы составляет приблизительно 1,025 кг/л.
Белки плазмы крови
Плазма крови содержит более 500 индивидуальных белков, которым присущи как общие функции, так и специфические.
Транспортная функция белков плазмы крови
- Трансферин – транспорт железа;
- Церулоплазмин – транспорт меди;
- Альбумин – транспорт жирных кислот, билирубина, кальция, многих лекарств;
- Транскортин – транспорт кортизола и кортикостерона;
- Ретинол связывающий белок – транспорт ретинола;
- Липопротеины – транспорт липидов;
- Гаптоглобин – транспорт свободного гемоглобина;
- Тироксин связывающий глобулин – транспорт тироксина.
Осмотическая регуляция — функция белков плазмы крови
Плазменные белки являются коллоидами и не способны к диффузии через полупроницаемые мембраны; они способны оказывать осмотическое (онкотическое) давление, которое помогает поддерживать нормальный объем крови и нормальное содержание воды в межклеточной жидкости и тканях. Наиболее важным в регуляции осмотического коллоидного или онкотического давления является содержание альбумина. При снижении содержания альбумина уровень потери воды из крови в интерстициальное пространство увеличивается, что сопровождается отеками.
Каталитическая функция белков плазмы крови
Ряд белков плазмы крови обладают ферментативными свойствами и образуют ферментативные системы.
Это белки плазмы, которые формируют системы
- комплемента,
- каликреин-кининовую,
- ангиотензин-рениновую,
- свертывания крови,
- фибринолиза.
В норме ферменты систем циркулируют в виде зимогенов, проферментов, активация их осуществляется с использованием каскадного принципа, механизм активации — ограниченный протеолиз. Все ферменты систем — сериновые протеазы с относительной субстратной специфичностью. Это значит, что активная форма фермента одной системы может активировать профермент-субстрат другой системы.
Защитная функция белков плазмы крови
- Система иммуноглобулинов распознаёт, связывает чужеродные антигены и удаляет их;
- Белки системы комплемента удаляют антигены – клетки, растворяют иммунные комплексы, опсонируют бактерии и способствуют их фагоцитозу, организуют реакцию воспаления: продукты активации системы комплемента мощные хематрактанты;
- Система ингибиторов ферментов – ингибируют активные ферменты, образуя с ними комплексы; например, α1-антитрипсина образует комплекс с эластазой и трипсином, защищая ткани, такие как легкое, от повреждающего действия гидролаз;
- Концентрация некоторых белков плазмы увеличиваются в течение острой фазы воспаления, эти белки способны защитить ткани. Например, α1- антитрипсин, α2- макроглобулин.
Свертывание крови — важнейшая функция белков плазмы крови
Многие белки (факторы) плазмы участвуют в механизме свертывания крови и предотвращают потерю чрезмерного количество крови. Например факторы свертывания крови IX, VIII, тромбин, фибриноген и т.д.; нарушение в системе этих белков приводит к развитию кровотечений или тромбозов
Противосвертывающая (антикоагулянтная) активность белков плазмы крови
Свертывание крови жестко контролируется белками плазмы с функцией ингибиторов активации свертывания крови.
Фибринолитическая активность (плазмин)
Растворение тромбов фибринолитической системой белков плазмы.
Буферная емкость белков плазмы
- Белки плазмы крови помогают поддерживать кислотно-щелочной баланс.
- Ряд белков плазмы выполняют специфические функции (табл.)
- Таблица – Специфические функции белков сыворотки крови
| Белок | Содержание в плазме (г/л) | Функция |
| Преальбумины | 0,4 | Связывание и транспорт Т3 и Т4 |
| Альбумин | 40 | Транспорт, коллоидно онкотическое давление |
| альфа1–глобулин: альфа1–антитрипсин | 3,0 | антипротеиназа |
альфа2–глобулины:
|
0,4 1,2 | транспорт меди, связывание свободного гемоглобина. |
| альфа2–макроглоюулин | 3,0 | транспорт, антипротеиназа |
бета–глобулины:
|
|
|
|
0.9–4.5 0,7 –2,8 8,0–18,0 |
|
Плазма крови: состав и свойства
Определение 1
Плазма крови (от греч. плазма – что-то образованное, сформированное) – жидкая часть крови, желтого цвета, со взвешенными форменными элементами.
Плазма в крови содержится около 50-60% от общей массы.
По макроскопическим свойствам плазма имеет вид однородную мутную жидкость желтого цвета. По гистологическим данным плазма представляет собой межклеточным веществом жидкой ткани крови.
Состав плазмы крови
Плазму из крови выделяют с помощью центрифуги-сепаратора. Плазма содержит в себе воду, которая содержит белки, и минеральные и органические соединения.
Белки плазмы:
- Альбумины. Низкая молекулярная массой. Составляет 5% от общей массы белков;
- α1 – глобулины;
- α2 – глобулины;
- β – глобулин;
- G – глобулин; Крупномолекулярные. Составляют 3% от общей массы белков;
- Фибриногены. Глобулярные белки. Составляют 0,4% от общей массы белков.
Питательные вещества плазмы:
- Глюкоза;
- Липиды;
- Гормоны;
- Ферменты;
- Витамины;
- Продукты обмена веществ;
- Неорганические вещества.
Неорганические элементы составляют 1% от общего состава плазмы крови. К ним относятся катионы натрия, калия, кальция, магния, и анионы хлорид, фосфат, карбонат. Эти ионы поддерживают нормальное состояние клеток и регулируют кислотно-щелочной баланс.
Ничего непонятно?
Попробуй обратиться за помощью к преподавателям
Группы небелковых веществ, плазмы крови:
1 группа содержит азотосодержащие вещества. В их состав входит 50% азот мочевины, 25% азот аминокислот; остальные 25% составляют пептиды, креатин, креатинин, индикан и билирубин. Высокий уровень азотосодержащих элементов сопроваждают патологию почек и обширные ожоги.
2 группа содержит органические безазотистые вещества. К ним относятся углеводы, липиды, продукты метаболизма, минеральные элементы крови.
Плотность плазма равна 1,025-1,029. рН плазмы – 7.
Свойства плазмы крови
Богатая тромбоцитами плазма применяется в медицине как стимулятор регенерации и заживления тканей организма.
Белки, входящие в состав плазмы обеспечивают свертываемость крови, транспортировку питательных элементов. Также функционирует кислотно-основной гемостаз и происходит поддержка агрегатного состояния кровотока.
Альбумины выполняют синтез печени. Также, выполняют питание клеток и тканей, транспортируют желчные вещества, выполняется резерв аминокислот.
Принимают участие:
- альбумины в доставке лекарственных компонентов.
- α – глобулины активизируют процесс выработки белков, выполняют транспортировку гормонов, липидов, и микроэлементов.
- β – глобулины участвуют в транспортировке катионов железа, цинка, фосфолипидов, стероидных гормонов и желчных стеринов.
- G – глобулины содержат антитела.
- Фибриноген влияет на свертываемость крови.
Замечание 1
В случае сильной кровопотери, ожогов и поддержки работы органов, в лечебной практике вливают пациенту физиологическую среду. Физиологическая среда компенсирует временную функцию. Поскольку изотонический 0,9 % раствор натрий хлорид идентичен по осмотическому давлению с давлением в кровотоке.
Смесь Рингера более адаптивен к крови, поскольку в него, кроме натрия хлорида, входят ионы кальция и калия карбида, и он является одновременно ионическим и изотоническим. Если в смесь Ренгера включается натрий гидрокарбонат, то она, по кислотно-щелочному балансу, считается равной крови.
Смесь Рингера-Локка напоминает состав натуральной плазмы, так кА содержит глюкозу. Смесь предназначается для поддержания сбалансированного давления крови во время кровотечения, обезвоживания и послеоперационного периода.
Функции плазмы
- Транспортная;
- Выделительная;
- Защитная;
- Гуморальная;
- Обеспечение солевого баланса;
- Гомеостатическая;
- Терморегуляторная;
- Механическая;
- Балансировка давления;
- Связывание экстраваскулярных жидкостей.
А. Белки плазмы крови
В плазме крови человека содержится около 100 различных белков. По подвижности при электрофорезе их можно грубо разделить на пять фракций: альбумин, α1-, α2-, β-, γ-глобулины. Разделение на альбумин и глобулин первоначально основывалось на различии в растворимости: альбумины растворимы в чистой воде, а глобулины — только в присутствии солей.
В количественном отношении среди белков плазмы наиболее представлен альбумин (около 45 г/л), который играет существенную роль в поддержании коллоидно-осмотического давления в крови и служит для организма важным резервом аминокислот.
Альбумин обладает способностью связывать липофильные вещества, вследствие чего он может функционировать в качестве белка-переносчика длинноцепочечных жирных кислот, билирубина, лекарственных веществ, некоторых стероидных гормонов и витаминов. Кроме того, альбумин связывает ионы Ca2+ и Mg2+.
К альбуминовой фракции принадлежит также транстиретин (преальбумин), который вместе с тироксин-связывающим глобулином [ТСГл (TBG)] и альбумином транспортирует гормон тироксин и его метаболит йод-тиронин.
В таблице приведены другие свойства важных глобулинов плазмы крови. Эти белки участвуют в транспорте липидов (см. Липопротеины), гормонов, витаминов и ионов металлов, они образуют важные компоненты системы свёртывания крови (см.
Свёртывание крови); фракция γ-глобулинов содержит антитела иммунной системы (см. Антитела).
Образование и разрушение. Большинство белков плазмы синтезируется в клетках печени. Исключение составляют иммуноглобулины, которые продуцируются плазматическими клетками иммунной системы (см. Иммунный ответ), и пептидные гормоны, секретируемые клетками эндокринных желез (см. Метаболизм пептидных гормонов). Кроме альбумина почти все белки плазмы являются гликопротеинами.
Они включают олигосахариды, присоединённые к аминокислотным остаткам N- и О-гликозидными связями (см. Окислительно-восстановительные коферменты). В качестве концевого остатка углеводной цепи часто выступает N-ацетилнейраминовая кислота (сиаловая кислота, см. Ферментативный катализ).
Если эта группа отщепляется нейраминидазой, ферментом находящимся в стенках кровеносных сосудов, на поверхности белка оказываются концевые остатки галактозы. Остатки галактозы асиалогликопротеинов (то есть десиалированных белков) узнаются и связываются рецепторами галактозы на гепатоцитах. В печени эти «состарившиеся» белки плазмы удаляются путём эндоцитоза.
Таким образом, олигосахариды на поверхности белка определяют время жизни белков плазмы, полупериод выведения (биохимический полупериод) которых составляет от нескольких дней до нескольких недель (см. Метаболизм стероидных гормонов).
В здоровом организме концентрация белков плазмы поддерживается на постоянном уровне. Однако их концентрация изменяется при заболевании органов, участвующих в синтезе и катаболизме этих белков. Повреждение тканей посредством цитокинов (см. Цитокины) увеличивает образование белков острой фазы, к которым принадлежат C-ре-активный белок, гаптоглобин, фибриноген, компонент C-3 комплемента и некоторые другие.
Статьи раздела «Белки плазмы крови»:
- Белки плазмы крови
- А. Белки плазмы крови
- Б. Электрофорез
— Следущая статья | — Вернуться в раздел
144. Основные белковые фракции плазмы крови и их функции. Значение их определения для диагностики заболеваний. Энзимодиагностика
В плазме крови содержится 7% всех белков
организма при концентрации 60 — 80 г/л.
Белки плазмы крови выполняют множество
функций. Одна из них заключается в
поддержании осмотического давления,
так как белки связывают воду и удерживают
её в кровеносном русле. Белки плазмы
образуют важнейшую буферную систему
крови и поддерживают рН крови в пределах
7,37 — 7,43.
Альбумин, транстиретин, транскортин,
трансферрин и некоторые другие белки
выполняют транспортную функцию. Белки
плазмы определяют вязкость крови и,
следовательно, играют важную роль в
гемодинамике кровеносной системы. Белки
плазмы крови являются резервом аминокислот
для организма. Иммуноглобулины, белки
свёртывающей системы крови, α1-антитрипсин
и белки системы комплемента осуществляют
защитную функцию.
Методом электрофореза
на ацетилцеллюлозе или геле агарозы
белки плазмы крови можно разделить на
альбумины (55-65%), α1-глобулины (2-
4%), α2-глобулины (6-12%), β-глобулины
(8-12%) и γ-глобулины (12-22%). Применение
других сред для электрофоретического
разделения белков позволяет обнаружить
большее количество фракций. Например,
при электрофорезе в полиакриламидном
или крахмальном гелях в плазме крови
выделяют 16-17 белковых фракций.
Метод
иммуноэлектрофореза, сочетающий
электрофоретический и иммунологический
способы анализа, позволяет разделить
белки плазмы крови более чем на 30 фракций.
Большинство сывороточных белков
синтезируется в печени, однако некоторые
образуются и в других тканях. Например,
γ-глобулины синтезируются В-лимфоцитами,
пептидные гормоны в основном секретируют
клетки эндокринных желёз, а пептидный
гормон эритропоэтин — клетки почки.
Для
многих белков плазмы, например альбумина,
α1-антитрипсина, гаптоглобина,
транс-феррина, церулоплазмина,
α2-макроглобулина и иммуноглобулинов,
характерен полиморфизм.
Почти
все белки плазмы, за исключением
альбумина, являются гликопротеинами.
Олигосахариды присоединяются к белкам,
образуя гликозидные связи с гидроксильной
группой серина или треонина, или
взаимодействуя с карбоксильной группой
аспарагина. Концевой остаток олигосахаридов
в большинстве случаев представляет
собой N-ацетилнейраминовую кислоту,
соединённую с галактозой.
Фермент
эндотелия сосудов нейраминидаза
гидролизует связь между ними, и галактоза
становится доступной для специфических
рецепторов гепатоцитов. Путём эвддцитоза
«состарившиеся» белки поступают
в клетки печени, где разрушаются. Т
1/2белков плазмы крови составляет
от нескольких часов до нескольких
недель. При ряде заболеваний происходит
изменение соотношения распределения
белковых фракций при электрофорезе по
сравнению с нормой.
Такие изменения
называют диспротеинемиями, однако их
интерпретация часто имеет относительную
диагностическую ценность. Например,
характерное для нефротического синдрома
снижение альбуминов, α1- и
γ-глобулинов и увеличение α2- и
β-глобулинов отмечают и при некоторых
других заболеваниях, сопровождающихся
потерей белков.
При снижении гуморального
иммунитета уменьшение фракции γ-глобулинов
свидетельствует об уменьшении содержания
основного компонента иммуноглобулинов
— IgG, но не отражает динамику изменений
IgA и IgM. Содержание некоторых белков в
плазме крови может резко увеличиваться
при острых воспалительных процессах и
некоторых других патологических
состояниях (травмы, ожоги, инфаркт
миокарда).
Такие белки называют
белками острой фазы, так как они
принимают участие в развитии воспалительной
реакции организма. Основной индуктор
синтеза большинства белков острой фазы
в гепатоцитах — полипептид интерлейкин-1,
освобождающийся из мононуклеарных
фагоцитов.
К белкам острой фазы относятС-реактивный белок, называемый
так, потому что он взаимодействует с
С-полисахаридом пневмококков,
α1-антитрипсин, гаптоглобин, кислый
гликопротеин, фибриноген. Известно, что
С-реактивный белок может стимулироватьсистему
комплемента, и его концентрация в крови,
например, при обострении ревматоидного
артрита может возрастать в 30 раз по
сравнению с нормой. Белок плазмы крови
α1-антитрипсин может инактивировать
некоторые протеазы, освобождающиеся в
острой фазе воспаления.
Альбумин.Концентрация
альбумина в крови составляет 40-50 г/л. В
сутки в печени синтезируется около 12 г
альбумина, Т1/2 этого белка
— примерно 20 дней. Альбумин состоит из
585 аминокислотных остатков, имеет 17
дисульфидных связей и обладает
молекулярной массой 69 кД. Молекула
альбумина содержит много дикарбоновых
аминокислот, поэтому может удерживать
в крови катионы Са2+, Cu2+,
Zn2+.
Около 40% альбумина содержится
в крови и остальные 60% в межклеточной
жидкости, однако его концентрация в
плазме выше, чем в межклеточной жидкости,
поскольку объём последней превышает
объём плазмы в 4 раза. Благодаря
относительно небольшой молекулярной
массе и высокой концентрации альбумин
обеспечивает до 80% осмотического давления
плазмы. При гипоальбуминемии осмотическое
давление плазмы крови снижается.
Это
приводит к нарушению равновесия в
распределении внеклеточной жидкости
между сосудистым руслом и межклеточным
пространством. Клинически это проявляется
как отёк. Относительное снижение объёма
плазмы крови сопровождается снижением
почечного кровотока, что вызывает
стимуляцию системы ренинангиотензинальдрстерон,
обеспечивающей восстановление объёма
крови.
Однако при недостатке альбумина,
который должен удерживать Na+, другие
катионы и воду, вода уходит в межклеточное
пространство, усиливая отёки.
Гипоальбуминемия может наблюдаться и
в результате снижения синтеза альбуминов
при заболеваниях печени (цирроз), при
повышении проницаемости капилляров,
при потерях белка из-за обширных ожогов
или катаболических состояний (тяжёлый
сепсис, злокачественные новообразования),
при нефротическом синдроме, сопровождающемся
альбуминурией, и голодании.
Нарушения
кровообращения, характеризующиеся
замедлением кровотока, приводят к
увеличению поступления альбумина в
межклеточное пространство и появлению
отёков. Быстрое увеличение проницаемости
капилляров сопровождается резким
уменьшением объёма крови, что приводит
к падению АД и клинически проявляется
как шок. Альбумин — важнейший транспортный
белок.
Он транспортирует свободные
жирные кислоты , неконъюгированный
билирубин Са2+, Сu2+, триптофан,
тироксин и трийодтиронин. Многие
лекарства (аспирин, дикумарол,
сульфаниламиды) связываются в крови с
альбумином. Этот факт необходимо
учитывать при лечении заболеваний,
сопровождающихся гипоальбуминемией,
так как в этих случаях повышается
концентрация свободного лекарства в
крови. Кроме того, следует помнить, что
некоторые лекарства могут конкурировать
за центры связывания в молекуле альбумина
с билирубином и между собой.
Транстиретин (преальбумин)называют тироксинсвязывающим
преальбумином.Это белок острой
фазы. Транстиретин относят к фракции
альбуминов, он имеет тетрамерную
молекулу. Он способен присоединять в
одном центре связывания ретинолсвязывающий
белок, а в другом — до двух молекул
тироксина и трийодтиронина.
Соединение
с этими лигандами происходит независимо
друг от друга. В транспорте последних
транстиретин играет существенно меНbшую
роль по сравнению с тироксинсвязывающим
глобулином.
α1 — Антитрипсинотносят
к α1-глобулинам. Он ингибирует ряд
протеаз, в том числе фермент эластазу,
освобождающийся из нейтрофилов и
разрушающий эластин альвеол лёгких.
При недостаточности α1-антитрипсина
могут возникнуть эмфизема лёгких и
гепатит, приводящий к циррозу печени.
Существует несколько полиморфных форм
α1-антитрипсина, одна из которых
является патологической. У людей,
гомозиготных по двум дефектным аллелям
гена антитрипсина, в печени синтезируется
α1-антитрипсин, который образует
агрегаты, разрушающие гепатоциты.
Это
приводит к нарушению секреции такого
белка гепатоцитами и к снижению содержания
α1-антитрипсина в крови.
Гаптоглобинсоставляет
примерно четверть всех α2-глобулинов.
Гаптоглобин при внутрисосудистом
гемолизе эритроцитов образует комплекс
с гемоглобином, который разрушается в
клетках РЭС.
Если свободный гемоглобин,
имеющий молекулярную массу 65 кД, может
фильтроваться через почечные клубочки
или агрегировать в них, то комплекс
гемоглобин-гаптоглобин имеет слишком
большую молекулярную массу (155 кД), чтобы
пройти через гломерулы. Следовательно,
образование такого комплекса предотвращает
потери организмом железа, содержащегося
в гемоглобине.
Определение содержания
гаптоглобина имеет диагностическое
значение, например, снижение концентрации
гаптоглобина в крови наблюдают при
гемолитической анемии.
Это объясняют
тем, что при Т1/2 гаптоглобина,
составляющем 5 дней, и Т1/2 комплекса
гемоглобин — гаптоглобин (около 90 мин)
увеличение поступления свободного
гемоглобина в кровь при гемолизе
эритроцитов вызовет резкое снижение
содержания свободного гаптоглобина в
крови. Гаптоглобин относятк белкам
острой фазы, его содержание в крови
повышается при острых воспалительных
заболеваниях.
Содержание и функции некоторых белков
плазмы крови
| Группа | Белки | Концентрация в сыворотке крови, г/л | Функция |
| Альбумины | Транстиретин | 0,25 | Транспорт тироксина и трийодтиронина |
| Альбумин | 40 | Поддержание осмотического давления, транспорт жирных кислот, билирубина, жёлчных кислот, стероидных гормонов, лекарств, неорганических ионов, резерв аминокислот | |
| α1-Глобулины | α1-Антитрипсин | 2,5 | Ингибитор протеиназ |
| ЛПВП | 0,35 | Транспорт холестерола | |
| Протромбин | 0,1 | Фактор II свёртывания крови | |
| Транскортин | 0,03 | Транспорт кортизола, кортикостерона, прогестерона | |
| Кислый α1-гликопротеин | 1 | Транспорт прогестерона | |
| Тироксинсвязывающий глобулин | 0,02 | Транспорт тироксина и трийодтиронина | |
| α2-Глобулины | Церулоплазмин | 0,35 | Транспорт ионов меди, оксидоредуктаза |
| Антитромбин III | 0,3 | Ингибитор плазменных протеаз | |
| Гаптоглобин | 1 | Связывание гемоглобина | |
| α2-Макроглобулин | 2,6 | Ингибитор плазменных протеиназ, транспорт цинка | |
| Ретинолсвязыва-ющий белок | 0,04 | Транспорт ретинола | |
| Витамин D связывающий белок | 0,4 | Транспорт кальциферола | |
| β-Глобулины | ЛПНП | 3,5 | Транспорт холестерола |
| Трансферрин | 3 | Транспорт ионов железа | |
| Фибриноген | 3 | Фактор I свёртывания крови | |
| Транскобаламин | 25×10-9 | Транспорт витамина B12 | |
| Глобулин связывающий белок | 20×10-6 | Транспорт тестостерона и эстрадиола | |
| С-реактивный белок |
Биология и медицина
Белки плазмы крови выполняют следующие функции:
1. Питательная
функция:
В организме человека содержится около 3 л плазмы, в которой
растворено примерно 200 г белка. Это вполне достаточный запас питательных веществ . Обычно клетки захватывают не
столько белки, сколько
аминокислоты , однако некоторые клетки могут захватывать белки плазмы и
расщеплять их при помощи собственных внутриклеточных ферментов.
Высвобождающиеся при этом аминокислоты поступают в кровь, где сразу же
могут использоваться другими клетками для синтеза новых белков.
2.
Транспортная функция:
Многие небольшие молекулы при переносе их от
кишечника или депо к месту потребления связываются со специфическими
белками плазмы.
Все белки плазмы связывают катионы крови и переводят их
в недифффундирующую форму. Так, около 2/3 кальция плазмы неспецифически
связано с белками. Связанный кальций находится в равновесии со свободно
растворенным в плазме ионизированным физиологически активным кальцием.
3. Роль белков в создании коллоидно-осмотического
давления .
Вследствие низкой молекулярной концентрации белков вклад
их в общее осмотическое давление плазмы крови невелик, но создаваемое ими
коллоидно- осмотическое (онкотическое) давление играет важную роль в регулировании распределения воды между плазмой и
межклеточной жидкостью .
Стенки капилляров
свободно пропускают небольшие молекулы, поэтому концентрации этих молекул и
создаваемое ими осмотическое давление примерно одинаковы в плазме и в
межклеточной жидкости.
Крупные молекулы белков плазмы лишь с большим трудом
проходят через стенки капилляров (так, период полувыведения меченного альбумина из кровотока составляет
примерно 14 часов). Кроме того, белки захватываются клетками и переносятся
лимфой .
Поэтому между плазмой и межклеточной
жидкостью создается градиент концентрации белков, обусловливающий разницу в
коллоидно-осмотическом давлении, составляющую примерно 22 мм рт.ст. (3
кПа). Любые изменения осмотически эффективной концентрации белков плазмы
приводят к нарушениям обмена веществами и распределения воды между кровью и межклеточной
жидкостью .
4. Буфферная функция.
Так как белки плазмы могут
взаимодействовать как с кислотами, так и с основаниями с образованим солей,
они участвуют в поддержании постоянства рН .
5. Роль белков в предупреждении кровопотери
.
Свертывание крови , препятствующее
кровотечению, частично обусловлено наличием в плазме фибриногена . Процесс свертывания включает целую
цепь реакций, в которых в качестве ферментов участвует ряд белков плазмы, и
заканчивается превращением растворенного в плазме фибриногена в сеть из фибрина , образующую сгусток.
Ссылки:
- Плазма крови: белки
- БЕЛКИ: ФУНКЦИИ, ОБЩИЕ СВЕДЕНИЯ
- БЕЛКИ: ФУНКЦИИ
Биохимическое исследование крови: белок плазмы крови и его фракции
Главная » Направление в медицине » Лабораторная диагностика »
Кровь состоит из жидкой части и форменных элементов — клеток крови. Если выпустить кровь из сосуда в сухую пробирку, то через несколько минут, в ней образуется сгусток темно-красного цвета, состоящий из нитей фибрина. Светло-желтая жидкость над сгустком — сыворотка.
Если кровь смешать с консервирующим раствором и дать отстояться или подвергнуть центрифугированию, то она разделится на два основных слоя: нижний — красного цвета — осадок из форменных элементов (эритроцитов, лейкоцитов, тромбоцитов) и верхний — прозрачная желтоватая жидкость — плазма. Сыворотка отличается от плазмы отсутствием в ней белка фибриногена, перешедшего в сгусток крови.
Кровь на 55% состоит из плазмы и на 45% — из форменных элементов, которые находятся в ней во взвешенном состоянии.
Плазма — это сложная биологическая среда, содержащая 92% воды, 7% белка и 1% жиров, углеводов и минеральных солей.
Белки плазмы (сыворотки) крови представляют собой высокомолекулярные азотсодержащие соединения. Они имеют сложное строение, в их состав входит более 20 аминокислот. Последние получили свое название благодаря наличию аминных групп (NН2) и карбоксильных (кислотных) групп (СООН). Аминокислоты обладают свойствами как кислот, так и оснований и могут вступать во взаимодействие с различными соединениями.
Аминокислоты, соединяясь друг с другом, образуют крупные молекулы различных белков. Человеческий организм содержит более 100 тысяч видов различных белковых молекул. По форме они могут быть разделены на фибриллярные и глобулярные.
Фибриллярные белки имеют удлиненную, нитевидную форму; длина молекул в десятки и сотни раз превышает их диаметр. Молекулы глобулярных белков имеют форму шара (комочка), длина их превышает диаметр не более чем в 3-10 раз. Имеются и переходные формы.
В состав белков входят углерод (50,6-54,6%), кислород (21,5-23,5%), водород (6,5-7,3%), азот (15-16%). Кроме того, в состав белков входят в небольшом количестве сера, фосфор, железо, медь и некоторые другие элементы.
Химические свойства белков во многом подобны аминокислотам. Молекула белка, так же как и молекула аминокислоты, содержит по меньшей мере одну свободную аминогруппу и одну карбоксильную группу.
Поскольку в молекулу белка входит огромное количество аминокислот, то таких «свободных групп» очень много. Благодаря наличию свойств кислот и оснований белки могут вступать в самые разнообразные химические реакции с самыми различными веществами, выполняя свои многочисленные функции в организме.
Белки условно делят на простые и сложные. Простыми называют белки, которые состоят только из аминокислот. К ним относят протамин, гистоны, альбумины, глобулины и ряд других.
При распаде сложных белков наряду с аминокислотами образуются и другие соединения: нуклеиновые кислоты, фосфорная кислота, углеводы и т. д. К группе сложных белков относят нуклеопротеиды, хромопротеиды, фосфопротеиды, глюкопротеиды, липопротеиды и ряд белков — ферментов, содержащих различные простетические (небелковые) группы.
Белки способны отдавать или получать электрический заряд, становясь заряженными положительно или отрицательно. Если это происходит одновременно, молекула белка становится электронейтральной.
Физико-химические свойства белков определяют их гидрофильностъ — способность удерживать воду, создавая коллоидный раствор. Одна кислотная группа (СООН) способна связать четыре, а аминная (NH2) — три молекулы воды.
Каждая белковая молекула окружена достаточно плотной собственной водной оболочкой, прочно фиксированной на ее поверхности. Сила, с которой белки плазмы притягивают к себе воду, называется коллоидно-осмотическим, или онкотическим давлением. Оно равно 23-28 мм рт. ст.
При уменьшении количества белков или снижении их гидрофильности в плазме образуется избыток «свободной» воды, повышается гидростатическое давление в мельчайших сосудах (капиллярах) и вода начинает просачиваться сквозь стенки капилляров в ткани. Образуются онкотические (т. е. зависящие от количества и свойств белков) отеки. Возникновение отеков связано и со многими другими причинами.
Кроме активного участия в водном обмене белки плазмы крови выполняют еще ряд важнейших функций. Они участвуют в процессе свертывания крови.
Обладая множеством полярных диссоциирующих боковых цепей, белки способны связывать и транспортировать различные биологические вещества. Являясь одной из важнейших буферных систем крови, белки поддерживают постоянство гомеостаза — кислотно-основное состояние (КОС) крови. Белки плазмы защищают организм от проникновения чужеродных элементов; в том числе чужеродных белков.
В клинической практике определяют общее содержание белка в плазме крови и его фракции.
Общее количество белка в плазме крови составляет 65-85 г/л. В сыворотке крови белка на 2-4 г/л меньше, чем в плазме из-за отсутствия фибриногена.
Общее количество белка может быть пониженным (гипопротеинемия) или повышенным (гиперпротеинемия).
Гипопротеинемия возникает вследствие:
- недостаточного поступления белка в организм;
- повышенной потери белка;
- нарушения образования белка.
Недостаточное поступление белка может быть следствием длительного голодания, безбелковой диеты, нарушения деятельности желудочно-кишечного тракта. Значительная потеря белка происходит при острых и хронических кровотечениях, злокачественных новообразованиях.
Выраженная гипопротеинемия — постоянный симптом нефритического синдрома, наблюдающегося при многих заболеваниях почек и связанного с выделением с мочой большого количества белка.
Нарушение образования белка возможно при недостаточности функции печени (гепатиты, циррозы, дистрофии печени).
Гиперпротеинемия развивается вследствие дегидратации (обезвоживания) — потери части внутрисосудистой жидкости. Это происходит при перегревании организма, обширных ожогах, тяжелых травмах, некоторых заболеваниях (холере).
Гиперпротеинемия наблюдается при миеломной болезни — тяжелом страдании с разрастанием плазматических клеток, продуцирующих парапротеины.
Состав белков плазмы крови чрезвычайно разнообразен. Современными методами исследования удалось, идентифицировать более 100 различных белков плазмы, большинство из них выделено в чистом виде и охарактеризовано.
Наиболее простые белки — альбумины, глобулины и фибриноген — находятся в плазме в больших количествах, остальные — в ничтожно малых.
Различия белков по аминокислотному составу, физико-химическим свойствам позволили разделить их на отдельные фракции, обладающие специфическими биологическими свойствами.
Наиболее точно разделение можно осуществить в электрическом поле при электрофорезе.
Метод основан на том, что белки с различным электрическим зарядом перемещаются с разной скоростью.
Электрофорез белков плазмы впервые осуществил шведский ученый А. Тизелиус (1930).
В плазме крови здорового человека при электрофорезе на бумаге можно обнаружить пять фракций: альбумины (50-70%), альфа-1-глобулины (3-6%), альфа-2 -глобулины (9-15%), бета -глобулины (8-18%) и гамма-глобулины (15-25%).
При использовании других сред (агаровый гель, полиакриламидный гель) или иммуноэлектрофореза можно получить большее число фракций.
Альбумины составляют большую часть белков плазмы. Они хорошо удерживают воду, на их долю приходится до 80% коллоидно-осмотического давления крови.
Гипоальбуминемия (пониженное содержание альбуминов в плазме крови) возникает вследствие тех же причин, что и снижение общего количества белка (малое поступление с пищей, большие потери белка, нарушение его синтеза, повышение распада). Гипоальбуминемия вызывает снижение онкотического давления крови, что приводит к возникновению отеков. Гидрофильность белков понижают различные отравляющие вещества, алкоголь.
Гиперальбуминемия наблюдается при обезвоживании организма.
Глобулины. Увеличение содержания альфа-глобулинов наблюдается при воспалительных процессах; стрессовых воздействиях на организм (травмы, ожоги, инфаркт миокарда и др.). ,
Это белки так называемой острой фазы. Степень увеличения альфа-глобулинов отражает интенсивность процесса.
Преимущественное увеличение альфа-2-глобулинов отмечается при острых гнойных заболеваниях, вовлечении в патологический процесс соединительной ткани (ревматизм, системная красная волчанка и др.).
Повышение содержания альфа-глобулинов возможно также при некоторых хронических заболеваниях, злокачественных новообразованиях, особенно при метастазировании.
Уменьшение альфа-глобулинов отмечается при угнетении их синтеза в печени, гипотиреозе — пониженной функции щитовидной железы.
Бета-глобулины. В этой фракции присутствуют липопротеиды, поэтому количество бета-глобулинов увеличивается при гиперлипопротеидемиях. Это наблюдается при атеросклерозе, сахарном диабете, гипотиреозе, нефротическом синдроме.
Повышение содержания гамма-глобулинов (гипергаммаглобулинемия) наблюдается при усилении иммунных процессов.
Оно обусловлено повышением продукцией иммуноглобулинов классов G, А, М, D, E и наблюдается при острых и хронических вирусных, бактериальных, паразитарных инфекциях, заболеваниях соединительной ткани (коллагенозах), злокачественных заболеваниях крови, некоторых опухолях.
Значительная гипергаммаглобулинемия характерна для хронических активных гепатитов.
При некоторых заболеваниях (миеломная болезнь, заболевания крови, злокачественные новообразования) появляются особые патологические белки — парапротеины — иммуноглобулины, лишенные свойств антител. В этих случаях также наблюдается гипергаммаглобулинемия.
Уменьшение гамма-глобулинов отмечается при заболеваниях и состояниях, связанных с истощением, угнетением иммунной системы (хронические воспалительные процессы, аллергия, злокачественные заболевания в терминальной стадии, длительная терапия стероидными гормонами, СПИД).
Рудницкий Л.В.